2021-2022学年安徽省亳州市涡阳一中高二(上)第二次质检化学试卷
发布:2024/4/20 14:35:0
一、选择题:本题共16小题,每小题3分,共48分。每小题只用一个选项符合题目要求、
-
1.化学与生活、科技密切相关,下列说法正确的是( )
组卷:1引用:1难度:0.6 -
2.以下事实不能用勒夏特列原理来解释的是( )
组卷:3引用:2难度:0.6 -
 3.某反应由两步反应ABC构成,反应过程中的能量变化曲线如图所示(E1、E2表示两反应的活化能)。下列有关叙述正确的是( )组卷:26引用:6难度:0.5
3.某反应由两步反应ABC构成,反应过程中的能量变化曲线如图所示(E1、E2表示两反应的活化能)。下列有关叙述正确的是( )组卷:26引用:6难度:0.5 -
4.弱电解质在水溶液中的电离过程是一个可逆过程。常温下,关于弱电解质的电离过程,说法正确的是( )
组卷:65引用:4难度:0.5 -
5.25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=6a,Va<Vb下列有关a的说法正确的是( )
组卷:140引用:10难度:0.5 -
6.室温下,在pH=12的某溶液中,由水电离的c(OH-)为( )
①1.0×10-7 mol•L-1 ②1.0×10-6 mol•L-1 ③1.0×10-2 mol•L-1 ④1.0×10-12 mol•L-1.组卷:18引用:3难度:0.5
二、非选择题
-
 19.甲醇 (CH3OH ) 是一种可再生能源,具有广阔的开发和应用前景。一定条件下,可用合 成气( CO、H2 )合成甲醇:2H2(g)+CO(g)⇌CH3OH(g)回答下列问题:
19.甲醇 (CH3OH ) 是一种可再生能源,具有广阔的开发和应用前景。一定条件下,可用合 成气( CO、H2 )合成甲醇:2H2(g)+CO(g)⇌CH3OH(g)回答下列问题:
(1)已知断裂1mol 有关化学键所吸收的能量数据如下表:
上述反应的 ΔH=化学键 H−H O−H C−H C≡O C−O 能量/kJ 436 462.8 413.4 1075 351 。(注:CO 和 N2 结构相似)
(2)在三个不同容积的容器中分别充入1molCO 与 2molH2,恒温恒容下发生上述反应,测得平衡时 CO 的转化率如下表:
①若实验Ⅱ中CO和 H2用量均加倍,则 CO 转化率实验 温度(℃) 容器体积 CO 转化率 平衡压强 ( p ) Ⅰ 200 V1 50% p1 Ⅱ 200 V2 70% p2 Ⅲ 350 V3 50% p2 70%;V1V2 (填“>”“=”或“<”,下同)。
②350℃时,实验Ⅲ反应的平衡常数 Kc=(用含V3 的代数式表示)。
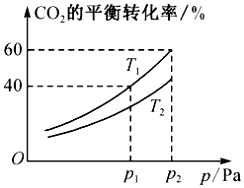
(3)工业上,CO2 和 H2 反应也可以合成甲醇。CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=−49.58kJ•mol-1。在恒压的密闭容器中,充入一 定量的 CO2 和 H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示。
①比较 T1 与 T2 的大小关系:T1(填“<”“=”或“>”)T2。
②在 T1 和 P2 的条件下,向密闭容器中充入1molCO2和3molH2,反应达到平衡时,容器 的容积为2.4L。保持 T1和此时容器的容积不变,再充入1molCO2 和3molH2,设达到平衡时CO2的总转化率为α,写出一个能够解出α的方程:(不用化简,不带单位)。
(4)以 CO2、H2 为原料合成 CH3OH 涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=−49.5kJ•mol-1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=−90.4kJ•mol−1
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH 3
一定条件下,向体积为 VL 的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑmol,CO 为bmol,平衡时反应Ⅲ的平衡常数为。 (用含 a、b、V 的代数式表示)组卷:36引用:1难度:0.6 -
20.过氧化氢其水溶液适用于医用伤口消毒及环境消毒和食品消毒。
I.过氧化氢性质实验
(1)酸性条件下H2O2可将水中的Fe2+转化成Fe3+,由此说明H2O2具有性。请写出该反应离子方程式:。
(2)已知H2O2是一种二元弱酸,其中Ka1=1.0×10-12、Ka2=1.05×10-25;则H2O2的电离方程式为,常温下1mol/L的H2O2溶液的pH为。
II.过氧化氢含量的实验测定
兴趣小组同学用0.1000mol/L酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
(3)滴定到达终点的现象是。
(4)用移液管吸取25.00mL 试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
计算试样中过氧化氢的浓度为第一次 第二次 第三次 第四次 体积(mL) 17.10 18.10 18.00 17.90 mol/L。
(5)若滴定前尖嘴中有气泡,滴定后消失,则测定结果(“偏高”“偏低”或“不变”)。组卷:93引用:4难度:0.7


