2022-2023学年江苏省南京市六校联合体高二(下)期末化学试卷
发布:2024/7/29 8:0:9
一、单项选择题:共13题,每题3分,共39分。
-
1.化学为人类科技发展作出巨大贡献。下列物质主要成分属于纤维素的是( )
组卷:27引用:1难度:0.9 -
2.
 少量Na2O2与CO2反应生成Na2CO3和O2。下列说法正确的是( )组卷:44引用:1难度:0.8
少量Na2O2与CO2反应生成Na2CO3和O2。下列说法正确的是( )组卷:44引用:1难度:0.8 -
3.常见的非金属元素和金属元素及其化合物是中学化学核心知识。下列说法正确的是( )
组卷:52引用:1难度:0.7 -
4.下列有关SO2的实验原理或方案能达到目的的是( )
组卷:15引用:1难度:0.5 -
5.阅读下列材料,完成5~7题。
氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ•mol-1。肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。
下列说法正确的是( )组卷:28引用:0难度:0.50
二、非选择题:共4题,共61分。
-
16.硝酸铈铵[(NH4)2Ce(NO3)6]为橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作氧化剂和分析试剂;二氧化铈(CeO2)为白色或黄白色固体,难溶于水,有强氧化性,主要用于玻璃、催化剂、电子管等工业。(NH4)2Ce(NO3)6和CeO2均是常见的强氧化剂,可用Ce2(CO3)3(难溶于水)为原料进行制取。
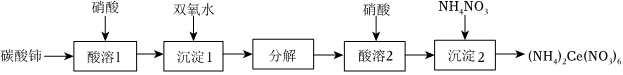
(1)碳酸铈可溶于硝酸中,写出酸溶1的离子方程式:。
(2)“沉淀1”时,溶液中Ce(NO3)3转化为Ce(OH)3(HO2)沉淀。写出沉淀1反应的化学方程式:。
(3)“酸溶2”时,控制反应温度为80℃,硝酸与Ce(OH)3(HO2)分解产生的Ce(OH)4反应生成H2Ce(NO3)6,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,原因是。
(4)“沉淀2”时,控制其他条件一定,改变加入NH4NO3固体的量,测得(NH4)2Ce(NO3)6沉淀的收率如图-1所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入n(NH4NO3):n(Ce)=4:1的目的是。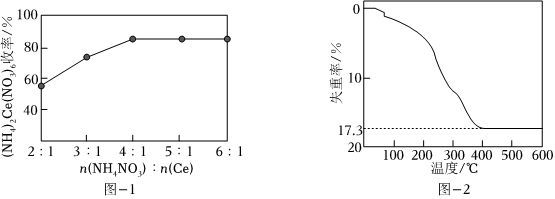
(5)已知:4Ce(OH)3(白色沉淀)+O2+2H2O═4Ce(OH)4(黄色沉淀),Ce(OH)4受热分解时失重百分比与温度的关系如图-2所示。实验小组以Ce2(CO3)3为原料制取CeO2,请设计实验方案:将Ce2(CO3)3完全溶解于盐酸中,,得CeO2固体。[须选用的试剂和仪器:2mol•L-1氨水、O2、1mol•L-1HNO3、1mol•L-1AgNO3溶液、马弗炉(可用于固体的高温加热)]组卷:27引用:1难度:0.5 -
17.回收利用含硫化合物有利于节约资源、保护环境。
(1)一种由含H2S的烟气回收硫黄的工艺为:将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫黄(S8)。该工艺中涉及反应为:
反应1:2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)ΔH1=akJ•mol-1(a<0)
反应2:4H2S(g)+2SO2(g)═3S2(g)+4H2O(g)ΔH2=bkJ•mol-1(b>0)
反应3:4S2(g)═S8(s)ΔH3=ckJ•mol-1(c<0)
如果上述反应均能完全进行,为提高硫黄的产率,该工艺中需要控制反应1和反应2烟气的体积比为。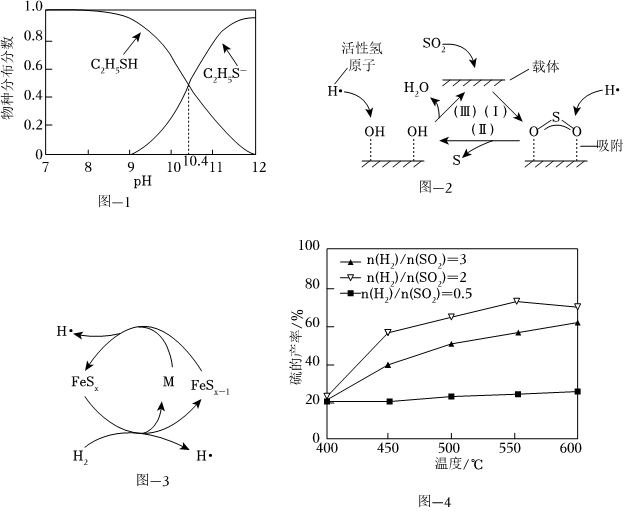
(2)某工业废水中含有乙硫醇(C2H5SH),已知C2H5SH水溶液中的物种分布分数如图1所示。已知:Ka1(H2S)=9×10-8,分别从电离常数和共价键极性的角度比较H2S和C2H5SH酸性强弱:
①(电离常数);
②(共价键极性)。
(3)一种以Al2O3为催化剂载体、FeS2为催化剂的H2还原烟气中SO2制S的反应机理如图-2和图-3所示:
①图-2中所示的转化过程可描述为。
②图-3中FeSx和H2反应生成M、FeSx-1和H•的化学方程式为。
③其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率与温度和比值的关系如图-4所示。500℃时,n(H2)n(SO2)比值为3时硫的产率小于比值为2时的原因是n(H2)n(SO2)。组卷:35引用:1难度:0.6


