2022-2023学年广东省深圳市高级中学高二(上)期中化学试卷
发布:2024/9/19 2:0:8
一、单选题(每小题只有一个选项符合题意,共10题,每题2分,共20分)
-
1.新中国成立以来,我国在载人飞船、北斗卫星、高铁、5G技术等领域取得了举世瞩目的成就。它们均与化学有着密切的联系。下列说法正确的是( )
组卷:30引用:2难度:0.8 -
2.下列化学用语使用正确的是( )
组卷:28引用:2难度:0.8 -
3.已知NA是阿伏加德罗常数的值,下列说法正确的是( )
组卷:5引用:2难度:0.5 -
4.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
组卷:86引用:5难度:0.7 -
5.下列实验装置能达到对应实验目的的是( )
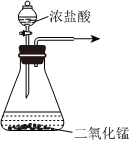
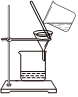
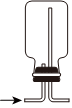
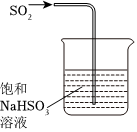
A.实验室制备Cl2 B.分离NaCl溶液和Fe(OH)3胶体 C.排气法收集NO2 D.尾气处理SO2 组卷:0引用:2难度:0.5 -
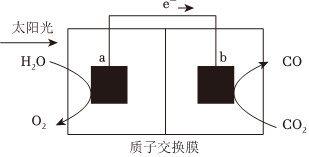 6.利用如图所示装置可以将温室气体CO2转化为燃料气体CO,下列说法正确的是( )组卷:15引用:2难度:0.7
6.利用如图所示装置可以将温室气体CO2转化为燃料气体CO,下列说法正确的是( )组卷:15引用:2难度:0.7
三、填空题(共4题,共计56分)
-
19.加强对工业废水、废气的处理,可以保护环境,利于健康,某电镀废水中含有重金属铬(Ⅵ)污染物,而硫酸工业会产生废气SO2,有人考虑综合处理可降低污染。
(1)硫酸工业的尾气中含SO2等污染性气体,研究发现Na2SO3溶液可以用来处理废气中的SO2,产生亚硫酸氢钠,发生反应Na2SO3+H2O+SO2═2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
①常温时,NaHSO4溶液呈弱酸 HClO H2CO3 H2SO3 电离平衡常数(25℃) Ka═4.0×10-8 Ka1═4.3×10-7
Ka2═4.7×10-11Ka1═1.5×10-3
Ka2═6×10-8(填“酸”、“碱”或“中”)性,其原因是(用电离方程式表示)。
②相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是(填化学式)。
③将未知浓度的NaHSO3和Na2SO3等体积混合,溶液pH═7.0,分析该溶液中c(HSO3-)c(SO32-)填“>”,“<”或“═”)。
(2)废水中铬(Ⅵ)主要以Cr2O72-和CrO42-形式存在,处理的方法是将铬(Ⅵ)还原为Cr3+,再转化为Cr(OH)3沉淀。常温下,Cr2O72-与CrO42-在溶液中存在如下平衡:Cr2O72-+H2O⇌2CrO42-+2H+,该反应的平衡常数K═1×10-14。
①若废水中Cr(Ⅵ)的总的物质的量浓度c[Cr(Ⅵ)]总═2c(Cr2O72-)+c(CrO42-)═0.201mol•L-1,要将废水中c(Cr2O72-):c(CrO42-)调节为100:1,则需调节溶液的pH═。(忽略调节pH时溶液体积的变化)
②一种还原酸性废水中Cr(Ⅵ)的方法是向其中加入NaHSO3,写出Cr2O72-所发生反应的离子方程式:。
(3)有关该平衡Cr2O72-+H2O⇌2CrO42-+2H+说法正确的是(填序号)。
A.反应达平衡时,Cr2O72-和CrO42-的浓度相同
B.加入少量水稀释,溶液中离子总数增加
C.溶液的颜色不变,说明反应达到平衡
D.加入少量K2Cr2O7固体,平衡时c2(CrO42-)与c(Cr2O72-)之比保持不变组卷:26引用:2难度:0.5 -
20.一碳化学是以分子中只含一个碳原子的化合物为原料生产化工产品的方法。合成气(CO和H2的混合气体)是一碳化学的重要原料,焦炭与水蒸气在刚性密闭容器中会发生如下两个反应:
I:C(s)+H2O(g)=CO(g)+H2(g)
II:CO(g)+H2O(g)=CO2(g)+H2(g)
下表是几种物质的标准生成热(由对应稳定单质生成1mol 某种物质的焓变叫做该物质的标准生成热)。
(1)反应I的焓变ΔH1=物质 C(s) H2O(g) CO(g) H2(g) 标准生成热/kJ•mol-1 0.0 -241.8 -110.5 0.0 kJ•mol-1,Ea正、Eb逆分别表示该反应正、逆反应的活化能,则Ea正Eb逆(填“>”或“<”或“=”)。
(2)若在绝热恒容容器中仅发生反应I,则下列事实能说明反应达到平衡状态的是。
A.容器内气体的压强不变
B.容器内温度不变
C.容器内气体的密度不再改变
D.容器内气体的平均相对分子质量不变
(3)已知反应II的正反应速率v正=k正•p(CO)•p(H2O),逆反应速率v逆=k逆•p(CO2)•p(H2),k正、k逆分别为正、逆反应速率常数,lgk(k表示k正或k逆)与温度的关系如图所示,其中直线ab分别表示k正、k逆随温度的变化。升高温度,反应I的平衡常数K1T(填“变大”或“变小”或“不变”)。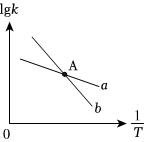
(4)在图A点对应的温度下,向某刚性密闭容器中加入足量焦炭和一定量水蒸气,同时发生反应Ⅰ和反应I。已知起始时容器内压强为80kPa,10分钟后体系达到平衡状态,容器内压强变为100kPa。
①平衡时CO的分压p(CO)=kPa,平衡时水蒸气的转化率为%
②进一步提高水蒸气平衡转化率的方法有(写两种不同的方法)。组卷:31引用:3难度:0.5


