2022-2023学年上海市杨浦区高二(下)期末化学试卷
发布:2024/6/23 8:0:10
一、价态繁多的铁元素
-
1.铁元素存在于岩石与生命体中,不同价态的铁元素在生产、生活乃至生命活动中有独特的作用。
(1)下列反应能得到单质铁的是。
A.Cu与FeCl3溶液反应
B.在高温下Al与Fe3O4反应
C.在高温下CO与Fe2O3反应
D.Fe(OH)3受热分解
(2)能说明Fe的还原性弱于Na的是。
A.Na的熔点比Fe的熔点低
B.1mol的Fe、Na分别与S反应,Fe失电子数多
C.Na与冷水剧烈反应,Fe与冷水不反应
D.Fe3+氧化性强于Na+
(3)实验室盛放FeSO4溶液的试剂瓶中通常需要加入少量铁粉,铁粉的作用是。
水处理厂可用Fe2(SO4)3制备的Na2FeO4对水进行杀菌、消毒等。
(4)Fe2(SO4)3制备Na2FeO4时,从氧化还原角度考虑,不可能用到的物质是。
A.NaClO
B.Na2O2
C.Na2S
D.Na2SO3
Fe2(SO4)3溶液也可用于处理工业尾气SO2。将SO2缓慢通入Fe2(SO4)3溶液至过量,观察到溶液由黄色变红棕色,静置后变为浅绿色。由资料知Fe2(SO4)3和SO2发生如下反应:
①Fe3++6SO2⇌[Fe(SO2)6]3+(红棕色)
②Fe3++SO2+=Fe2+(浅绿色)++SO2-4H+
(5)请补全、配平反应②,并标出电子转移的数目和方向。
(6)实验中,溶液由黄色变为红棕色的过程中也可能有Fe(OH)3胶体生成,请写出检验是否有胶体生成的方法。
(7)浅绿色溶液中可能混有SO2,请写出检验该溶液中混有SO2的方法。
(8)请从化学反应速率与化学平衡移动的角度解释向Fe2(SO4)3溶液中通入SO2的实验现象。组卷:76引用:1难度:0.5
四、塑料工业中的重要材料
-
4.聚丙烯和聚苯乙烯是常用塑料中的两种。聚丙烯常用于食品容器、薄膜等。聚苯乙烯一般用于泡沫塑料、家电外壳等。
(1)丙烯是乙烯的同系物,其官能团的名称是。丙烯。(双选)
A.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
B.其加聚产物的链节为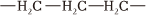
C.分子中最多有8个原子共平面
D.分子中无手性碳原子(手性碳原子是指与四个各不相同原子或基团相连的碳原子)
(2)CH2=CHCH2CH(CH3)2是丙烯二聚物,它是合成“人工肺”设备膜丝的原料。则丙烯二聚体。(双选)
A.与 互为同分异构体
互为同分异构体
B.加聚产物能使溴水褪色
C.催化加氢产物的一氯代物有5种(不考虑立体异构)
D.与等质量丙烯完全燃烧耗氧量相同
以甲烷为原料合成聚苯乙烯等产品的一种流程如图(部分产物及反应条件略去):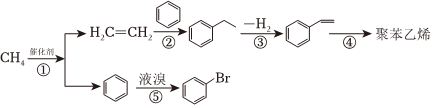
(3)CH4与Cl2在光照下反应能得到CH2Cl2,关于CH2Cl2的描述错误的是。(单选)
A.结构式: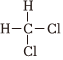
B.不存在同分异构体
C.二氯甲烷为正四面体结构
D.常温常压下为液体
(4)反应②的反应类型为反应。
(5)写出反应④的化学方程式。。
(6)写出符合下列条件的乙苯的同分异构体的结构简式。属于芳香烃且分子中不同化学环境的氢原子数比为6:2:1:1。。
(7)已知:①
②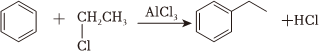
③苯环上原有取代基对新取代基的位置有影响:甲基一般使新取代基在其邻对位,硝基使新取代基在其间位。
依据题中信息及所学知识,写出以苯为原料制备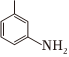 的合成路线流程图 (无机试剂、两碳以下的有机试剂任用)。(合成路线的表示方式为:甲乙••••••反应试剂反应条件目标产物)反应试剂反应条件
的合成路线流程图 (无机试剂、两碳以下的有机试剂任用)。(合成路线的表示方式为:甲乙••••••反应试剂反应条件目标产物)反应试剂反应条件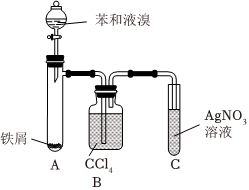
(8)实验室常用如图所示装置完成反应⑤。根据C中的白雾及溶液中产生淡黄色沉淀可推断出苯与液溴发生了取代反应。这一推断的理由是:。组卷:35引用:1难度:0.5
五、家庭常用的除湿剂
-
5.氯化钙的用途广泛。在生产生活中常被用做干燥剂,因其溶解放热可用于制作自加热罐头,也可用于食品添加剂等。
(1)常见的干燥剂
(2)已知市售氯化钙除湿剂主要成分为CaCl2•2H2O浓H2SO4 有强腐蚀性,不适合家庭除湿。
①下列不可用浓H2SO4干燥的气体是。(双选)
A.CO B.NH3 C.H2S D.H2碱石灰  主要成分为氧化钙和氢氧化钠
主要成分为氧化钙和氢氧化钠
②实验中常置于如图所示(填装置名称)中使用。铁粉 可用于食品干燥,称为“双吸剂”。
③除吸收水分之外,还可吸收。(单选)
A.CO2 B.N2 C.O2氯化钙 ④吸水性强,可用于家庭除湿。CaCl2 。(双选)
A.是离子化合物 B.两种微粒核外电子排布不同
C.是漂白粉的有效成分 D.是粗盐易潮解的原因之一
①确认该除湿剂中的Cl-。简述检验Cl-的方法:。
②如图是某氯化钙除湿剂受热时固体质量的变化曲线,已知剩余固体全部为CaCl2,该除湿剂的纯度为。(保留3位小数)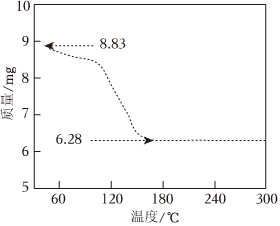
(3)探究氯化钙除湿剂的使用过程
①如图是挂式家用氯化钙除湿剂装置示意图。下表是CaCl2溶解度表。温度/℃ 0 10 20 30 40 60 80 溶解度/g 59.5 64.7 74.5 100 128 137 147 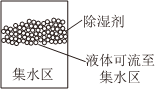
氯化钙除湿剂吸水后变成溶液进入集水区,但使用时发现即使室温变化不大时,在集水区也会有晶体析出,请结合溶解度表和题给CaCl2性质,尝试解释上述现象的原因。。
②氯化钙除湿剂说明中写道:不慎渗漏后可用小苏打水擦拭。取一定量集水区溶液于试管中,加入0.5mol/L的NaHCO3溶液,有白色沉淀和无色气体生成,该气体能使澄清石灰水变浑浊,请写出试管中发生反应的离子方程式。。(杂质不与NaHCO3溶液反应)组卷:7引用:1难度:0.5


