2022-2023学年上海财经大学附属北郊高中高二(下)期末化学试卷
发布:2024/6/6 8:0:9
铜的应用
-
1.铜是人类使用最早的金属之一。在化学反应中,铜元素可表现为0、+1、+2价。
(1)西汉古籍记载“曾青(CuSO4)得铁即化为铜”,该反应的离子方程式为。
(2)黄铜是铜锌合金,外观呈金黄色。鉴别黄铜和黄金,以下方法可行的是(双选)。
A.观察颜色
B.称量质量
C.加稀盐酸
D.高温灼烧
(3)某同学想要利用反应Cu+2H+Cu2++H2↑来制备CuSO4,应选择装置一定条件(单选)。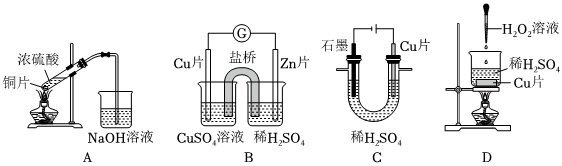
(4)赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将两种矿物按一定比例混合加热,可发生反应:Cu2S+Cu2O△Cu+SO2↑。
①该反应的氧化剂是。
②配平该反应。
③每生成标准状况下2.24LSO2,反应中转移电子数目为。
(5)Cu2O是大型水面舰艇防护涂层的重要原料,实验室可以用乙醛还原法制备Cu2O。
①写出相应的反应式:。
②实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要。组卷:11引用:1难度:0.6
抗新冠新药的合成
-
4.有机化合物G是一种抗新型冠状病毒口服药的合成中间体,其合成路线如图:
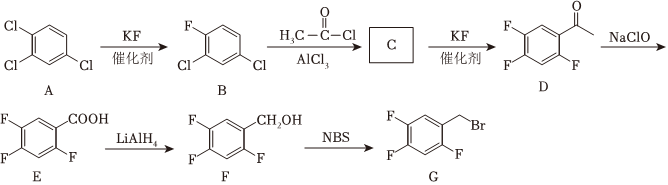
(1)A的系统命名为;G分子中至少有个原子共面。
(2)C→D的反应方程式为。
(3)D→E中新生成的官能团名称是;E→F的反应类型是。
(4)检验G中是否有少量F残留的操作是。
(5)写出一种同时满足下列条件的E的同分异构体的结构简式。
ⅰ.分子中含有苯环
ⅱ.属于酯类化合物,能发生银镜反应
ⅲ.分子中含有2种化学环境不同的氢原子
(6)化合物E的Ka为1.35×10-3,而苯甲酸(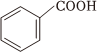 )的Ka为6.46×10-5,从结构角度解释两者Ka存在较大差异的原因 。
)的Ka为6.46×10-5,从结构角度解释两者Ka存在较大差异的原因 。
(7)设计以D为原料合成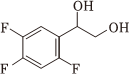 的路线 。组卷:21引用:2难度:0.5
的路线 。组卷:21引用:2难度:0.5
1,6-己二酸的制备
-
5.1,6-己二酸是常用的化工原料,在高分子材料、医药制造等方面都有重要作用。实验室利用图中的装置(夹持装置省略),以环己醇、浓硝酸为反应物制备1,6-己二酸。反应原理为:
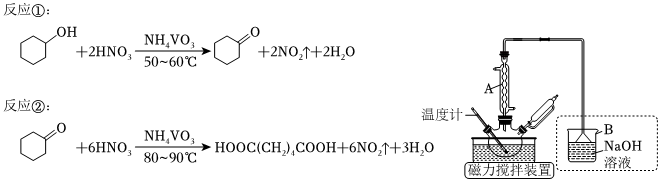
相关物质物理性质如下:
Ⅰ.进行反应①:向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量)。将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,用恒压滴液漏斗慢慢滴加6mL环己醇,使三颈烧瓶内温度维持在50~60°C之间,直至环己醇全部滴加完毕。试剂 相对分
子质量密度
/g•cm-3熔点/℃ 沸点/℃ 溶解性 环己醇 100 0.962 25.9 161.8 可溶于水、乙醇、苯 1,6-己二酸 146 1.360 152 300.5 微溶于冷水,易溶于乙醇,
不溶于苯NH4VO3 117 2.326 210(分解) —— 微溶于冷水,易溶于热水
(1)仪器A的作用是,使用时冷水从(填“上口”或“下口”)通入;虚线框内装置B的作用是。
(2)若水浴温度控制不当,未滴加环己醇前就会观察到红棕色气体生成,原因是。
(3)向三颈烧瓶中滴加环己醇时,反应温度迅速上升,说明反应①的ΔH0(填>、<或=);为使反应温度不致过高,必要时可采取的措施是(任写一种)。
Ⅱ.进行反应②:将三颈烧瓶放入80~90°C水浴中加热10min,至反应完全。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出。
(4)判断反应②已完全的标志是。
(5)从混合体系中分离白色晶体的步骤为:过滤、、干燥、得到粗品。
Ⅲ.粗品的提纯
(6)提纯1,6-己二酸粗品的方法是(单选)。
A.蒸馏
B.洗涤分液
C.重结晶
D.溶解过滤
(7)最终得到1,6-己二酸产品4.810g,则1,6-己二酸的产率为(精确到0.01%)。
(8)1,6-己二酸与1,6-己二醇形成的聚酯是常见的增塑剂,写出合成这种聚酯的反应式。组卷:16引用:1难度:0.5


