2023-2024学年四川省成都市石室中学高二(上)开学化学试卷
发布:2024/8/16 0:0:1
一、选择题(共14题,每题3分,共42分,每小题只有一个选项符合题意)
-
1.化学与生活有着密切联系,下列关于化学与生活的说法正确的是( )
组卷:27引用:1难度:0.5 -
2.下列关于反应2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)ΔH=-5800kJ•mol-1的叙述错误的是( )
组卷:48引用:2难度:0.5 -
3.以下实验装置能达到实验目的的是( )
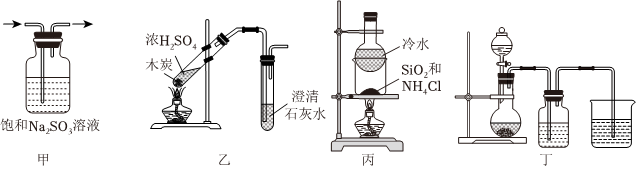 组卷:11引用:1难度:0.6
组卷:11引用:1难度:0.6 -
4.下列有关图象的描述不正确的是(已知图象中a、b均大于0)( )
组卷:17引用:2难度:0.6 -
5.海水晒盐后的盐卤中含Br-,可提取Br2,流程如图:
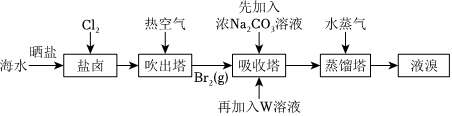
已知:①3Br2+3=5Br-+CO2-3+3CO2↑②5Br-+BrO-3+6H+=3Br2+3H2OBrO-3
下列说法不正确的是( )组卷:8引用:3难度:0.7 -
6.下列实验方案的设计和实验目的都正确的是( )
选项 实验方案 实验目的 A 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,观察气体产生的速度 比较Cu2+和Fe3+的催化效果 B 先向两支试管中各加入2mL1mol/L的酸性KMnO4溶液,再同时向两支试管分别加入2mL0.1mol/L的H2C2O4溶液和2mL0.05mol/L的H2C2O4溶液,记录高锰酸钾溶液褪色所需时间 探究草酸浓度对反应速率影响 C 分别向盛有2g锌粒(颗粒大小基本相同)的锥形瓶中加入40mL1mol/L和40mL18mol/L的硫酸,比较两者收集10mL气体所用的时间 探究硫酸浓度对反应速率影响 D 向某盐溶液中加入浓NaOH溶液,加热,观察是否产生使湿润的红色石蕊试纸变蓝的气体 通过实验现象探究该未知溶液中是否存在 NH+4组卷:6引用:1难度:0.6
二、非选择题(共4题,共58分)
-
17.肼(N2H4)是我国导弹和运载火箭中广泛使用的液体燃料之一,具有较强的还原性。某实验小组拟用 NH3和NaClO溶液反应制备肼,装置如图所示(夹持装置未画出)。
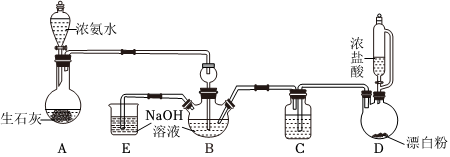
(1)装置A中制备NH3的化学方程式为。
(2)装置B中长颈漏斗的作用是;仪器C中盛放的试剂为。
(3)N2H4的电子式为,装置B中制备N2H4的化学方程式为。
(4)由于反应放热,通常把B装置放于温度较低的水浴中,目的是。
实验时,先打开A中的分液漏斗活塞得到饱和氨水后,再打开D中的漏斗活塞的原因是。
(5)测定产品中N2H4的质量分数
取装置B中的溶液4.00g,并调节为弱酸性,加水配成500mL溶液,从中取25.00mL溶液与0.2000mol/L的I2溶液反应(只有N2H4参与反应,其他物质不反应),反应过程中有无污染性的气体生成,消耗I2溶液的体积为20.00mL,则该产品中N2H4的质量分数为%。组卷:17引用:1难度:0.3 -
18.氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据如图数据计算反应:N2(g)+12H2(g)=NH3(g)的ΔH=32kJ/mol。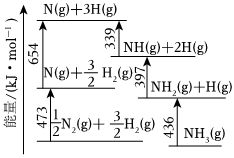
(2)合成氨气的氢气可由天然气制备。
①其反应如下CH4(g)+H2O(g)⇌CO(g)+3H2(g)ΔH=+206kJ/mol,该反应自发的条件是(填“低温自发”“高温自发”或“任意温度自发”);
②为提高CH4的平衡转化率,可采用的措施是(填序号);
A.使用合适的催化剂
B.采用较高的温度
C.采用较高的压强
D.延长反应时间
③某温度下,在1L密闭容器中充入0.2molCH4和1.0molH2O进行反应,达到平衡时再往容器内充入0.2molCH4和1.0molH2O,则该反应CH4转化率(填“变大”“变小”或“不变”)。
(3)催化剂的选择是合成氨的核心技术之一,使用催化剂1或催化剂2合成氨,产氨速率与温度的关系如图甲。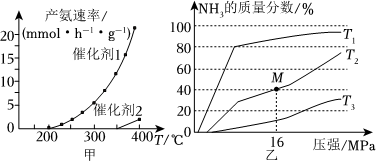
①由图判断,相同温度下,活化能Ea1Ea2(填“>”“<”或“=”,下同);
②在一定条件下,向某反应容器中投入5molN2和15molH2,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图乙所示,温度T1、T2、T3中,最大的是,M点N的转化率为;
③1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为r(NH3)=k1p(N2)-k2[p3(H2)p2(NH3)]α。k1、k2分别为正反应和逆反应的速率常数,p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);α为常数,工业上以铁为催化剂时,α=0.5。由M点数据计算[p2(NH3)p3(H2)](1-α)=k1k2(MPa)-2。
(4)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示: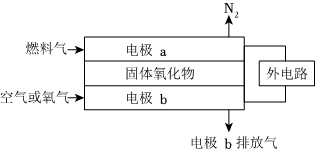
写出该电池的负极电极反应方程式。组卷:24引用:1难度:0.4


