氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
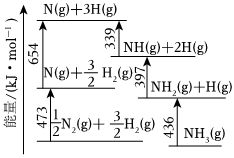
(1)根据如图数据计算反应:12N2(g)+32H2(g)=NH3(g)的ΔH=-45-45kJ/mol。
(2)合成氨气的氢气可由天然气制备。
①其反应如下CH4(g)+H2O(g)⇌CO(g)+3H2(g)ΔH=+206kJ/mol,该反应自发的条件是 高温自发高温自发(填“低温自发”“高温自发”或“任意温度自发”);
②为提高CH4的平衡转化率,可采用的措施是 BB(填序号);
A.使用合适的催化剂
B.采用较高的温度
C.采用较高的压强
D.延长反应时间
③某温度下,在1L密闭容器中充入0.2molCH4和1.0molH2O进行反应,达到平衡时再往容器内充入0.2molCH4和1.0molH2O,则该反应CH4转化率 变小变小(填“变大”“变小”或“不变”)。
(3)催化剂的选择是合成氨的核心技术之一,使用催化剂1或催化剂2合成氨,产氨速率与温度的关系如图甲。
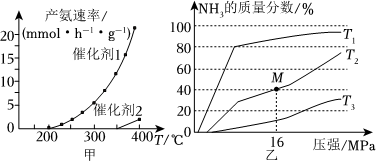
①由图判断,相同温度下,活化能Ea1<<Ea2(填“>”“<”或“=”,下同);
②在一定条件下,向某反应容器中投入5molN2和15molH2,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图乙所示,温度T1、T2、T3中,最大的是 T3T3,M点N的转化率为 40%40%;
③1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为r(NH3)=k1p(N2)[p3(H2)p2(NH3)]α-k2[p2(NH3)p3(H2)](1-α)。k1、k2分别为正反应和逆反应的速率常数,p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);α为常数,工业上以铁为催化剂时,α=0.5。由M点数据计算k1k2=0.0073或 1621870.0073或 162187(MPa)-2。
(4)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:
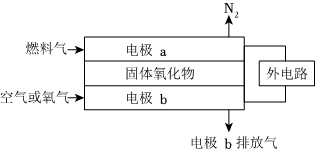
写出该电池的负极电极反应方程式 2NH3+3O2--6e-=N2+3H2O2NH3+3O2--6e-=N2+3H2O。
1
2
3
2
[
p
3
(
H
2
)
p
2
(
NH
3
)
]
α
[
p
2
(
NH
3
)
p
3
(
H
2
)
]
(
1
-
α
)
k
1
k
2
16
2187
16
2187
【答案】-45;高温自发;B;变小;<;T3;40%;0.0073或 ;2NH3+3O2--6e-=N2+3H2O
16
2187
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 0:0:1组卷:24引用:1难度:0.4


