2021-2022学年北京159中高二(上)期中化学试卷
发布:2024/5/21 8:0:9
一、选择题(每小题只有一个选项符合题意)
-
1.下列反应类型中属于化学平衡主要研究对象的是( )
组卷:152引用:8难度:0.9 -
2.下列电离方程式书写正确的是( )
组卷:95引用:3难度:0.3 -
3.下列物质属于弱电解质的是( )
组卷:17引用:6难度:0.9 -
4.下列食品添加剂中,其使用目的与反应速率有关的是( )
组卷:1720引用:89难度:0.8 -
5.下列与化学反应过程中的能量变化相关的叙述中,不正确的是( )
组卷:15引用:8难度:0.9 -
6.氧化亚铜常用于制船底防污漆。用CuO与Cu高温烧结可制取Cu2O,已知反应:
2Cu(s)+O2(g)═2CuO(s)ΔH=-314kJ/mol
2Cu2O(s)+O2(g)═4CuO(s)ΔH=-290kJ/mol
则CuO(s)+Cu(s)═Cu2O(s)ΔH等于( )组卷:72引用:2难度:0.8 -
7.对于反应A(g)+3B(g)⇌2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
组卷:28引用:8难度:0.9 -
8.当反应2SO2+O2⇌2SO3达到平衡后,通入少量18O2气体,再次达到平衡时,18O存在于( )
组卷:48引用:9难度:0.7 -
9.下列方法中可以说明2HI(g)⇌H2(g)+I2(g)已达到平衡的标志是( )
组卷:15引用:6难度:0.7 -
10.1mol氢气燃烧生成液态水,放出285.8kJ热量。下列热化学方程式正确的是( )
组卷:176引用:5难度:0.9
二、填空题
-
30.合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g)⇌2NH3(g)的化学平衡常数表达式为。
(2)对于反应N2(g)+3H2(g)⇌2NH3(g),在一定条件下氨的平衡含量如表。
①该反应为温度/℃ 压强/MPa 氨的平衡含量 200 10 81.5% 550 10 8.25% (填“吸热”或“放热”)反应。
②其他条件不变时,温度升高氨的平衡含量减小的原因是(填字母序号)。
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
(3)一定温度下,在容积恒定的密闭容器中充入1mol氮气和3mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1mol氮气和3mol氢气,氮气的平衡转化率(填“变大”“变小”或“不变”)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)⇌CO(g)+3H2(g) 获取,已知该反应中当初始混合气中的恒定时,温度、压强对平衡混合气CH4含量的影响如图。n(H2O)n(CH4)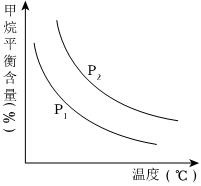
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”)。
②该反应为反应(填“吸热”或“放热”)。
(5)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为,该温度下反应的平衡常数K值为。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6组卷:10引用:2难度:0.5 -
31.氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气整制氢的部分反应过程如图1所示:
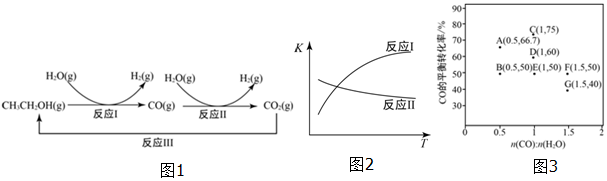
已知:反应I和反应II的平衡常数随温度变化曲线如图2所示。
(1)反应I中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ.反应I的热化学方程式是。(2)反应II,在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率如图3(各点对应的反应温度可能相同,也可能不同)。
①图中D、E两点对应的反应温度分别为TD和TE.判断:TDTE(填“<”“=”或“>”)。
②经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的相同。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是。组卷:5引用:4难度:0.6


