2022-2023学年湖南师大附中高二(上)期末化学试卷
发布:2024/9/1 0:0:9
一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1.下列离子的VSEPR模型与离子的空间立体构型一致的是( )
组卷:403引用:20难度:0.9 -
2.下列关于丙烯(CH3CH=CH2)分子的说法中,错误的是( )
组卷:136引用:2难度:0.7 -
3.下列说法错误的是( )
组卷:19引用:3难度:0.7 -
4.已知某原子的电子排布式为:1s22s22p63s23p63d84s2,该元素在周期表中的位置和区是( )
组卷:70引用:4难度:0.9 -
5.在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+与
反应生成砖红色沉淀指示滴定终点。已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,当溶液中的Cl-恰好沉淀完全(浓度等于1.0×10-5mol⋅L-1)时,溶液中c(CrO2-4)约为( )CrO2-4组卷:97引用:4难度:0.7 -
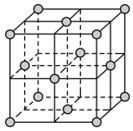 6.如图表示一个晶胞,该晶胞为正方体,结构粒子位于正方体的顶点和面心。下列说法正确的是( )组卷:98引用:4难度:0.6
6.如图表示一个晶胞,该晶胞为正方体,结构粒子位于正方体的顶点和面心。下列说法正确的是( )组卷:98引用:4难度:0.6
三、非选择题:本题共4小题,共54分。
-
17.硫代硫酸钠(Na2S2O3)是常见的分析试剂。实验室制备Na2S2O3溶液的装置如图(部分装置省略,C中Na2SO3过量):
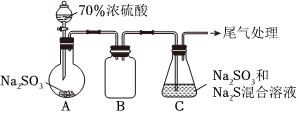
回答下列问题:
(1)装置A中盛放固体试剂的仪器名称为;制取SO2的反应中,利用了浓硫酸的性。
(2)装置B的作用是。
(3)装置C中的反应分两步,其中第二步反应方程式为S+Na2SO3=Na2S2O3。当观察到装置C中出现的现象,说明反应已完全。
(4)测定某样品中Na2S2O3⋅5H2O的含量的实验步骤如下(杂质不参加反应):
Ⅰ.取0.0100mol⋅L-1的K2Cr2O7溶液20.00mL,用硫酸酸化后,加入过量KI,发生反应:Cr2+6I-+14H+=2Cr3++3I2+7H2O。O2-7
Ⅱ.称取2.000g样品,配制成100mL溶液,取该溶液滴定步骤Ⅰ所得溶液(淀粉作指示剂)至终点。三次平行实验,平均消耗18.60mL样品溶液。发生的反应为I2+2S2=2I-+S4O2-3。O2-6
①步骤Ⅱ中滴定终点的现象为。
②样品中Na2S2O3⋅5H2O的质量分数为。
(5)装置C中反应一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:。组卷:20引用:2难度:0.7 -
 18.当发动机工作时,反应产生的NO尾气是主要污染物之一,NO的脱除方法和转化机理是当前研究的热点。请回答下列问题:
18.当发动机工作时,反应产生的NO尾气是主要污染物之一,NO的脱除方法和转化机理是当前研究的热点。请回答下列问题:
(1)已知:
2NO(g)+O2(g)=2NO2(g)ΔH1=-113kJ•mol-1
6NO2(g)+O3(g)=3N2O5(g)ΔH2=-227kJ•mol-1
4NO2(g)+O2(g)=2N2O5(g)ΔH3=-57kJ•mol-1
则2O3(g)=3O2(g)是反应(填“放热”或“吸热”),以上O3氧化脱除氮氧化物的总反应是NO(g)+O3(g)=NO2(g)+O2(g)ΔH4=,最后将NO2与剂反应转化为无污染的气体而脱除。
(2)已知:2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
①表中k1、k2、k3、k4是只随温度变化的常数,温度升高将使其数值步骤 反应 活化能 正反应速率方程 逆反应速率方程 Ⅰ 2NO(g)⇌N2O2(g)(快) Ea1 v1正=K1•C2(NO) v1逆=K2•C(N2O2) Ⅱ N2O2(g)+O2(g)⇌2NO2(g)(慢) Ea2 v2正=K3•c(N2O2)•c(O2) v2逆=K4•C2(NO2) (填“增大”或“减小”)。
②反应Ⅰ瞬间建立平衡,因此决定2NO(g)+O2(g)⇌2NO2(g)反应速率快慢的是,则反应Ⅰ与反应Ⅱ的活化能的大小关系为Ea1Ea2(填“>”“<”或“=”)。
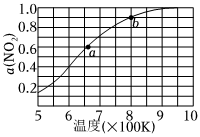
③反应2NO(g)+O2(g)⇌2NO2(g)的K=(用k1、k2、k3、k4表示)。
(3)将一定量的NO2放入恒容密闭容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从b点到a点降温,平衡将向移动。图中a点对应温度下,NO2的起始压强为160kPa,该温度下反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。组卷:38引用:3难度:0.5


