2022-2023学年江苏省苏州市梁丰高级中学高二(上)期末化学试卷
发布:2024/7/25 8:0:9
一、单项选择题(本题共10小题,每小题仅有一个正确答案,每小题3分,共30分)
-
1.水在一定条件下,可以变成低温下粘滞的粥状透明液体,称为玻璃态水。玻璃态水的体积不会像冰一样膨胀,对低温保存生命有一定的意义。下列关于玻璃态水的叙述,正确的是( )
组卷:10引用:2难度:0.7 -
2.在强酸性的澄清透明溶液中,能大量共存的离子组是( )
组卷:129引用:2难度:0.5 -
3.为除去粗盐中含有的硫酸钠、氯化镁、氯化钙等杂质,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质,将杂质转化为沉淀过滤除去,再向滤液中加入适量的盐酸得到精盐水。该过程示意如图:
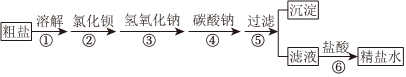
对该过程的认识中,正确的是( )组卷:50引用:4难度:0.5 -
4.水是组成生命体的重要化学物质,在下列反应中,水仅被还原的是( )
组卷:167引用:2难度:0.7 -
5.用NA表示阿伏伽德罗常数,下列说法正确的有( )
①标准状况下,11.2LO2和O3组成的混合气体含有原子数为NA
②0.1mol/L Na2SO4溶液中含有的Na+个数为0.2NA
③已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑,如果有5molH2O参加反应,则由水还原的BrF3分子数目为3NA
④12g石墨和C60的混合物中质子总数为6 NA
⑤5.6LN2(标准状况)和11gCO2中含有的分子数相同
⑥22.4LO2中一定含有2NA个O原子
⑦在常温常压下20mLNH3与60mLO2所含的原子个数比为2:3组卷:172引用:2难度:0.5 -
 6.晶体有规则几何外形,但有些晶体存在“缺陷”,从而引起含有的离子数量比发生变化,但整体仍呈电中性。如某种氧化镍(NiO)晶体中存在:1个Ni2+空缺,另有2个Ni2+被Ni3+取代,其组成可表示为Ni0.97CO,则其中Ni2+和Ni3+的离子数比为( )组卷:31引用:2难度:0.7
6.晶体有规则几何外形,但有些晶体存在“缺陷”,从而引起含有的离子数量比发生变化,但整体仍呈电中性。如某种氧化镍(NiO)晶体中存在:1个Ni2+空缺,另有2个Ni2+被Ni3+取代,其组成可表示为Ni0.97CO,则其中Ni2+和Ni3+的离子数比为( )组卷:31引用:2难度:0.7
三、填空题
-
 19.人类的生产和生活都离不开金属。
19.人类的生产和生活都离不开金属。
(一)金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致年代如图所示:
(1)由图可知人类最早使用的合金是;通过敲打可将金属材料打制成不同的形状,是利用了金属的性。
(2)北宋沈括在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾(硫酸铜晶体),熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是(填序号)
A.“苦泉”的溶质之一——CuSO4
B.“挹其水之”——蒸发溶剂
C.“熬胆矾铁釜,久之亦化为铜”——发生置换反应
(3)铝的利用距今100多年,现在铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是(用化学方程式表示)
(二)实验室探究铜的冶炼
已知:H2+CuOCu+H2O。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。△
Ⅰ、设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。
(4)图1中制取氢气的化学反应方程式为。
(5)实验开始时,(填序号)
A.先向长颈漏斗中加稀硫酸后点酒精灯
B.先点燃酒精灯加热后向长颈漏斗中加稀硫酸
(6)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到,证明固体产物有Cu2O。
Ⅱ、探究反应生成Cu2O的变化情况。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。
(7)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是。
(8)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是。
Ⅲ、探究反应生成Cu2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历2CuO+H2Cu2O+H2O,H2+Cu2O△2Cu+H2O两个反应,且在同一条件下两个反应同时进行。△
假设2:依次经历CuO+H2Cu+H2O、Cu+CuO△Cu2O、H2+Cu2O△Cu+H2O三个反应。△
(9)结合探究Ⅱ的结果,通过计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是。(写出合理的推理过程)
(三)用废铜屑生产硫酸铜晶体(CuSO4•5H2O)的流程如图:
(10)“溶解”时发生的化学反应方程式为。
(11)“洗涤、干燥”过程中常用95%的酒精做洗涤剂,优点是。
(12)取10gCuSO4•5H2O,其受热脱水过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示。则晶体CuSO4•3H2O存在的最高温度约为。 组卷:32引用:2难度:0.5
组卷:32引用:2难度:0.5
四、计算题
-
20.PbO2是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由Ca(ClO)2溶液氧化碱性Pb(OH)2法制备PbO2的步骤如图:

反应原理:2Pb(CH3COO)2+4NaOH+Ca(ClO)2=2PbO2↓+4CH3COONa+CaCl2+2H2O为测定产品(只含PbO2和PbO)中PbO2、PbO的物质的量之比,称取产品0.5194g,加入20.00mL0.2500mol⋅L-1H2C2O4溶液(PbO2还原为Pb2+,H2C2O4被氧化为CO2)搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去PbC2O4,滤液酸化后用0.0400mol⋅L-1KMnO4标准溶液滴定至终点(还原为Mn2+,H2C2O4被氧化为CO2),消耗标准溶液10.00mL。计算产品中n(PbO2)与n(PbO)物质的量之比MnO-4(写出计算过程)。组卷:20引用:2难度:0.5


