 人类的生产和生活都离不开金属。
人类的生产和生活都离不开金属。
(一)金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致年代如图所示:

(1)由图可知人类最早使用的合金是 青铜青铜;通过敲打可将金属材料打制成不同的形状,是利用了金属的 延展延展性。
(2)北宋沈括在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾(硫酸铜晶体),熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是 ABCABC(填序号)
A.“苦泉”的溶质之一——CuSO4
B.“挹其水之”——蒸发溶剂
C.“熬胆矾铁釜,久之亦化为铜”——发生置换反应
(3)铝的利用距今100多年,现在铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是 4Al+3O2=2Al2O34Al+3O2=2Al2O3(用化学方程式表示)
(二)实验室探究铜的冶炼
已知:H2+CuO △ Cu+H2O。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。
Ⅰ、设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。
(4)图1中制取氢气的化学反应方程式为 Zn+H2SO4=ZnSO4+H2↑Zn+H2SO4=ZnSO4+H2↑。
(5)实验开始时,AA(填序号)
A.先向长颈漏斗中加稀硫酸后点酒精灯
B.先点燃酒精灯加热后向长颈漏斗中加稀硫酸
(6)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到 溶液变蓝溶液变蓝,证明固体产物有Cu2O。
Ⅱ、探究反应生成Cu2O的变化情况。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。
(7)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是 先增大后减小先增大后减小。
(8)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是 通入足量氢气,加热较长时间通入足量氢气,加热较长时间。
Ⅲ、探究反应生成Cu2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历2CuO+H2 △ Cu2O+H2O,H2+Cu2O △ 2Cu+H2O两个反应,且在同一条件下两个反应同时进行。
假设2:依次经历CuO+H2 △ Cu+H2O、Cu+CuO △ Cu2O、H2+Cu2O △ Cu+H2O三个反应。
(9)结合探究Ⅱ的结果,通过计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是 假设0.6000gCuO全部变成Cu2O时,其质量为0.54g,而由图2可知Cu2O的最大质量为0.3218g,所以两个反应同时进行假设0.6000gCuO全部变成Cu2O时,其质量为0.54g,而由图2可知Cu2O的最大质量为0.3218g,所以两个反应同时进行。(写出合理的推理过程)
(三)用废铜屑生产硫酸铜晶体(CuSO4•5H2O)的流程如图:

(10)“溶解”时发生的化学反应方程式为 Cu+H2SO4+H2O2=CuSO4+2H2OCu+H2SO4+H2O2=CuSO4+2H2O。
(11)“洗涤、干燥”过程中常用95%的酒精做洗涤剂,优点是 酒精易挥发,无需加热烘干,可防止含结晶水晶体受热失去结晶水或有利于晶体快速干酒精易挥发,无需加热烘干,可防止含结晶水晶体受热失去结晶水或有利于晶体快速干。
(12)取10gCuSO4•5H2O,其受热脱水过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示。则晶体CuSO4•3H2O存在的最高温度约为 113℃113℃。
△
△
△
△
△
△
【答案】青铜;延展;ABC;4Al+3O2=2Al2O3;Zn+H2SO4=ZnSO4+H2↑;A;溶液变蓝;先增大后减小;通入足量氢气,加热较长时间;假设0.6000gCuO全部变成Cu2O时,其质量为0.54g,而由图2可知Cu2O的最大质量为0.3218g,所以两个反应同时进行;Cu+H2SO4+H2O2=CuSO4+2H2O;酒精易挥发,无需加热烘干,可防止含结晶水晶体受热失去结晶水或有利于晶体快速干;113℃
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/25 8:0:9组卷:32引用:2难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
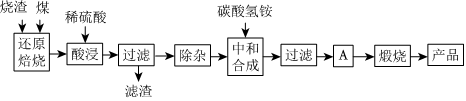
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
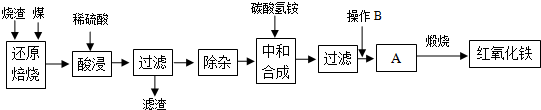
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
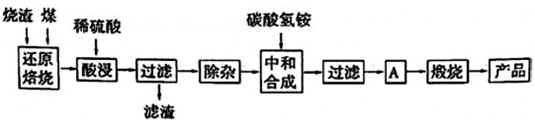
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


