2023-2024学年重庆市缙云教育联盟高二(上)质检化学试卷(9月份)
发布:2024/9/10 0:0:8
-
1.已知:101Ka时,1molH2完全燃烧生成液态水,放出285.8kJ的热量;1molCH4完全燃烧生成液态水和CO2,放出890.3kJ的热量。下列热化学方程式的书写正确的是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890.3kJ/mol
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol
④2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol组卷:19引用:2难度:0.6 -
2.热化学方程式2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1中,化学式前面的化学计量数表示( )
组卷:30引用:6难度:0.9 -
3.下列说法不正确的是( )
组卷:24引用:2难度:0.7 -
4.下列依据热化学方程式得出的结论正确的是( )
选项 热化学方程式 结论 A 2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1 H2的燃烧热为241.8kJ•mol-1 B OH-(aq)+H+(aq)═H2O(l)△H=-57.3kJ•mol-1 含1mol NaOH的稀溶液与浓H2SO4完全中和,放出热量小于57.3kJ C 2C(s)+2O2(g)═2CO2(g)△H=-akJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-bkJ•mol-1b<a D C(石墨,s)=C(金刚石,s)△H=+1.5kJ•mol-1 全刚石比石墨稳定 组卷:66引用:8难度:0.7 -
5.下列传统文化描述中,没有发生放热反应的是( )
组卷:10引用:3难度:0.7 -
6.工业上乙烯催化氧化制乙醛的某一反应原理为2CH2═CH2(g)+O2(g)
2CH3CHO(aq)△H,该反应原理可以拆解为如下三步反应:PdCl2-CuCl2-HCl-H2O
Ⅰ.CH2═CH2(g)+PdCl2(aq)+H2O(l)═CH3CHO(aq)+Pd(s)+2HCl(aq)△H1
Ⅱ.……
Ⅲ.4CuCl(s)+O2(g)+4HCl(aq)═4CuCl2(aq)+2H2O(l)△H3
若第Ⅱ步反应的反应热为△H2,且△H=2△H1+2△H2+△H3,则第Ⅱ步反应的热化学方程式为( )组卷:55引用:3难度:0.7
解答题
-
17.某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定。
(一)配制0.50mol•L-1NaOH溶液。
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体g。
(2)从图中选择称量NaOH固体所需要的仪器(填字母)。
(二)测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示。序号 a b c d e f 仪器 





(3)写出该反应的热化学方程式(中和热ΔH=-57.3kJ•mol-1):。
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写表中的空白:
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容C=4.18J•g-1•℃-1。则测得中和热ΔH=实验次数 起始温度T1/℃ 终止温度T2/℃ 温度差平均值
(T2-T1)/℃H2SO4 NaOH 平均值 1 26.2 26.0 26.1 30.1 2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.8 4 26.4 26.2 26.3 30.4 kJ•mol-1(取小数点后一位)。
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)。
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
C.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度组卷:9引用:1难度:0.7 -
18.Ⅰ.将50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是。
(2)中和热测定实验中,下列说法不正确的是。
A.改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,求出的中和热数值和原来不同
B.酸碱混合时,量筒中NaOH溶液应分三次倒入小烧杯中
C.所加NaOH溶液过量,目的是保证盐酸完全被中和
D.装置中隔热层的作用是保温隔热、减少热量损失
(3)他们记录的实验数据如下:
(已知:Q=cm(t2-t1),反应后溶液的比热容c为4.2kJ/(℃•kg),各物质的密度均为1g•cm-3)实验用品 溶液温度 中和热 t1 t2 ΔH ① 50mL0.55mol•L-1NaOH溶液 50mL0.5mol•L-1HCl溶液 20℃ 23.3℃ ② 50mL0.55mol•L-1NaOH溶液 50mL0.5mol•L-1HCl溶液 20℃ 23.5℃
①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热ΔH=kJ•mol-1。
②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值(填“偏大”“偏小”或“无影响”)。
③若用醋酸代替HCl做实验,对测定结果(填“偏大”“偏小”或“无影响”)。
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。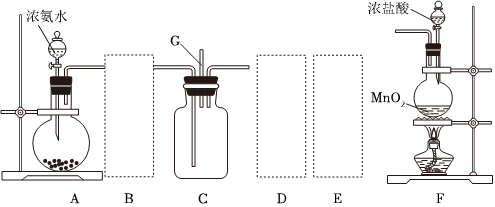
请回答下列问题:
(4)装置A中的烧瓶内固体不可选用(填字母)。
A.碱石灰
B.烧碱
C.生石灰
D.五氧化二磷
(5)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B、D、E从左至右依次选择的装置顺序为备选装置 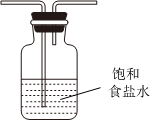
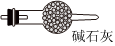
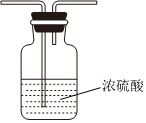
Ⅰ Ⅱ Ⅲ 。
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为。
(7)某研究小组设计了一套制备及检验SO2部分性质的装置: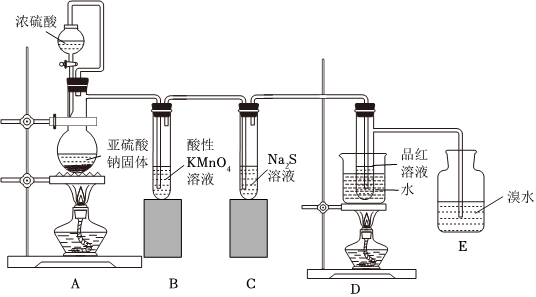
实验过程中观察到装置B中的现象是,反应的离子方程式为,C装置证明SO2具有性。
(8)E中的化学反应方程式为。
(9)D装置的作用是。组卷:12引用:1难度:0.5


