Ⅰ.将50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 玻璃搅拌棒玻璃搅拌棒。
(2)中和热测定实验中,下列说法不正确的是 ABAB。
A.改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,求出的中和热数值和原来不同
B.酸碱混合时,量筒中NaOH溶液应分三次倒入小烧杯中
C.所加NaOH溶液过量,目的是保证盐酸完全被中和
D.装置中隔热层的作用是保温隔热、减少热量损失
(3)他们记录的实验数据如下:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | ΔH | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ | |
①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热ΔH=
-57.12
-57.12
kJ•mol-1。②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值
偏小
偏小
(填“偏大”“偏小”或“无影响”)。③若用醋酸代替HCl做实验,对测定结果
偏小
偏小
(填“偏大”“偏小”或“无影响”)。Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
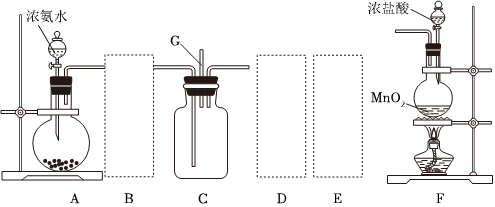
请回答下列问题:
(4)装置A中的烧瓶内固体不可选用
D
D
(填字母)。A.碱石灰
B.烧碱
C.生石灰
D.五氧化二磷
(5)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
| 备选装置 | ||
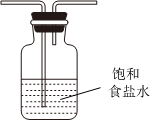 |
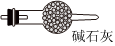 |
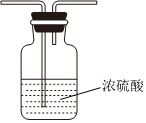 |
| Ⅰ | Ⅱ | Ⅲ |
Ⅱ、Ⅲ、Ⅰ
Ⅱ、Ⅲ、Ⅰ
。(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为
8NH3+3Cl2=N2+6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
。(7)某研究小组设计了一套制备及检验SO2部分性质的装置:
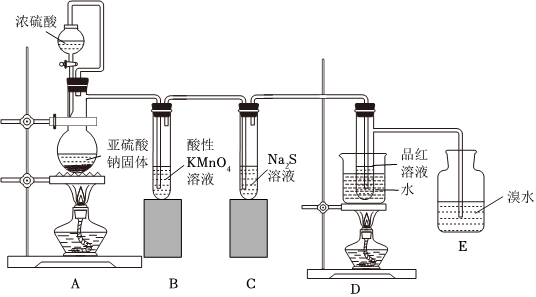
实验过程中观察到装置B中的现象是
高锰酸钾溶液褪色
高锰酸钾溶液褪色
,反应的离子方程式为 5
S
O
2
+
2
M
n
O
-
4
+
2
H
2
O
=
5
S
O
2
-
4
+
2
M
n
2
+
+
4
H
+
5
S
O
2
+
2
M
n
O
-
4
+
2
H
2
O
=
5
S
O
2
-
4
+
2
M
n
2
+
+
4
H
+
氧化
氧化
性。(8)E中的化学反应方程式为
SO2+2H2O+Br2=2HBr+H2SO4
SO2+2H2O+Br2=2HBr+H2SO4
。(9)D装置的作用是
验证SO2的漂白性具有不稳定性
验证SO2的漂白性具有不稳定性
。【答案】玻璃搅拌棒;AB;-57.12;偏小;偏小;D;Ⅱ、Ⅲ、Ⅰ;8NH3+3Cl2=N2+6NH4Cl;高锰酸钾溶液褪色;;氧化;SO2+2H2O+Br2=2HBr+H2SO4;验证SO2的漂白性具有不稳定性
5
S
O
2
+
2
M
n
O
-
4
+
2
H
2
O
=
5
S
O
2
-
4
+
2
M
n
2
+
+
4
H
+
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/10 0:0:8组卷:12引用:1难度:0.5
相似题
-
1.在测定中和热的实验中,下列说法正确的是( )
发布:2024/12/18 23:0:1组卷:88引用:2难度:0.7 -
2.掌握化学实验技能是进行科学探究的基本保证。下列有关说法正确的是( )
 发布:2024/12/17 3:0:1组卷:95引用:4难度:0.7
发布:2024/12/17 3:0:1组卷:95引用:4难度:0.7 -
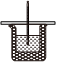 3.实验题:50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
3.实验题:50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃仪器是。
(2)写出表示该反应中和热的热化学方程式(中和热为57.3kJ•mol-1):(用离子方程式表示)。
(3)实验中改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求得的中和热(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大””、“偏小””或“无影响”)。
(5)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2~t1)分别为①3.3℃、②3.5℃、③4.5℃,则最终代入计算式的温差平均值为℃。计算该实验测得的中和反应反应热ΔH=(结果保留一位小数)[已知Q=cmΔt,设盐酸和NaOH溶液的密度为1g/cm3,反应后混合溶液的比热容(c)为4.18J/(g•℃)]。发布:2024/12/4 11:30:1组卷:60引用:3难度:0.6


