2022-2023学年四川省成都七中高三(下)入学化学试卷
发布:2024/8/27 0:0:9
一、选择题:本题共7个小题,每小题6分。共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1.化学与生产、生活、环境密切相关。下列说法正确的是( )
组卷:16引用:1难度:0.6 -
2.NA表示阿伏加德罗常数的值,下列说法正确的是( )
组卷:14引用:1难度:0.8 -
3.下列实验能达到目的的是( )
实验目的 实验方法或操作 A 测定中和反应的反应热 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 B 证明SO2能呈现酸性和氧化性 向Na2S溶液中通入足量SO2生成淡黄色沉淀 C 探究浓度对化学反应速率的影响 量取同体积不同浓度的NaClO溶液,分别加入等体积等浓度的Na2SO3溶液,对比现象 D 判断氧化性:Cl2<MnO2 向固体MnO2上加入浓盐酸 组卷:12引用:1难度:0.5
二、非选择题:本卷包括必考题和选考题两部分。必考题,每个试题考生都必须作答。选考题,考生根据要求作答。(一)必考题。
-
10.将二氧化碳转化为高附加值碳基燃料可有效减少碳排放。
二氧化碳加氢制甲醇[CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)]引起了科学界和工业界的极大兴趣。请回答下列问题。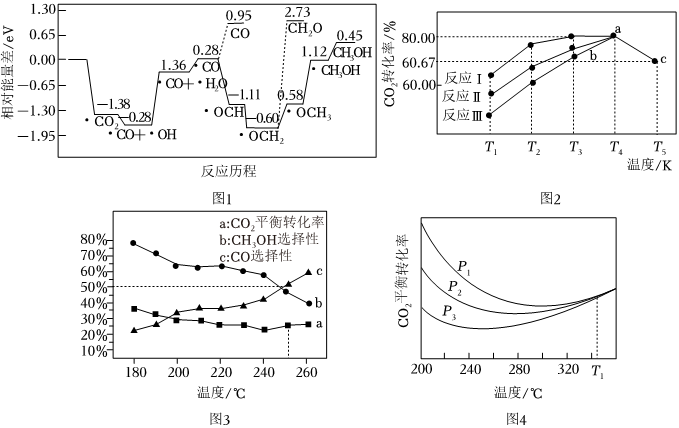
(1)相关的化学键键能数据如表所示:
写出二氧化碳催化加氢制甲醇的热化学方程式化学键 H-H C=O H-O C-H C-O E(kJ/mol) 436 745 465 413 351 。
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原CO2制备甲醇,该反应历程如图1所示。
①该过程产生的副产物有。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:。
(3)一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ制备甲醇,测得5min时CO2的转化率随温度变化如图2所示:
①T4温度下,反应Ⅱ在0~5min内平均反应速率v(H2)=。
②同一物质b点对应的正反应速率v(正)(填“>”“<”或“=”)c点对应逆反应速率v(逆)。
(4)向另一恒容密闭容器中按CO2和H2物质的量1:3投料,总物质的量为amol,在有催化剂的密闭容器中进行以下反应:
主反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2>0
测得CO2平衡转化率、CH3OH和CO选择性[转化的CO2中生成CH3OH或CO的百分比,如:CH3OH选择性=]随温度、压强变化情况分别如图3、图4所示:n(CH3OH)n(CH3OH)+n(CO)
①如图3,240℃以上,随着温度升高,CO2的平衡转化率增大,而CH3OH的选择性降低。分析其原因:。
②如图4,温度为T1℃时,三条曲线几乎交于一点,分析其原因:。
③250℃时,在容积为VL的容器中,主反应和副反应均达到化学平衡,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下副反应的平衡常数为。
(5)研究表明,在电解质水溶液中,Li-CO2电池中的CO2气体可被还原,而CO2在碱性介质中被还原为正丙醇 (CH3CH2CH2OH),其电极反应式为。组卷:26引用:1难度:0.4
(二)选考题。请考生从2道化学题中任选一题做答。并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则按所做的第一题计分。【化学选修3:物质结构与性质】
-
11.全球首次在350千米时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题。
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有种,若其电子排布式表示为[Ne]3s23违背了p2x。
(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3(填“>”或“<”)SiCl4,与SiCl4互为等电子体的离子为(任写一种即可)。
SiCl4 发生水解的机理如图: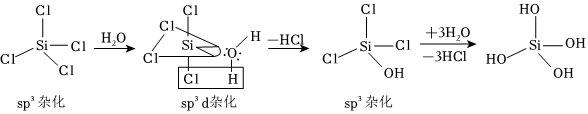
CCl4不能按照上述机理发生水解反应,原因是。
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],下列说法正确的是(填字母)。
A.CH3CN与Mn原子配位时,提供孤电子对的是C原子
B.Mn原子的配位数为6
C.CH3CN中C原子的杂化类型为sp2、sp3
D.CH3CN 中σ键与π键数目之比为5:2
②已知r(Co2+)=65pm,r(Mn2+)=67pm,推测MnCO3比CoCO3的分解温度(填“高”或“低”),解释原因:。
(4)铁酸钇是一种新型磁光材料,在光纤通讯领域有很好的应用前景。其正交晶胞结构如图a所示,沿z轴与x轴的投影图分别如图b和图c所示。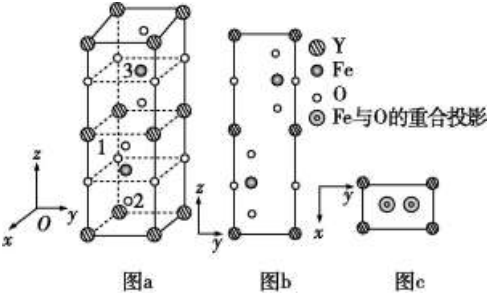
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。如1号原子的坐标为(0,0,),2号原子的坐标为(12,12-m,12-m),则3号Fe原子的坐标为14。
②若晶胞参数分别为apm、bpm、cpm,阿伏加德罗常数的值为NA,则晶体的密度为g•cm-3(列出计算表达式)。组卷:36引用:1难度:0.5


