将二氧化碳转化为高附加值碳基燃料可有效减少碳排放。
二氧化碳加氢制甲醇[CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)]引起了科学界和工业界的极大兴趣。请回答下列问题。
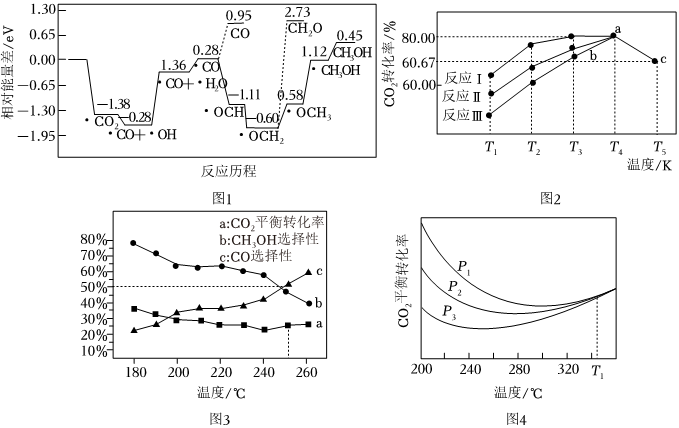
(1)相关的化学键键能数据如表所示:
| 化学键 | H-H | C=O | H-O | C-H | C-O |
| E(kJ/mol) | 436 | 745 | 465 | 413 | 351 |
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-187kJ/mol
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-187kJ/mol
。(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原CO2制备甲醇,该反应历程如图1所示。
①该过程产生的副产物有
CO、CH2O
CO、CH2O
。②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:
*CO+*OH→*CO+*H2O
*CO+*OH→*CO+*H2O
。(3)一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ制备甲醇,测得5min时CO2的转化率随温度变化如图2所示:
①T4温度下,反应Ⅱ在0~5min内平均反应速率v(H2)=
0.24mol/(L•min)
0.24mol/(L•min)
。②同一物质b点对应的正反应速率v(正)
<
<
(填“>”“<”或“=”)c点对应逆反应速率v(逆)。(4)向另一恒容密闭容器中按CO2和H2物质的量1:3投料,总物质的量为amol,在有催化剂的密闭容器中进行以下反应:
主反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2>0
测得CO2平衡转化率、CH3OH和CO选择性[转化的CO2中生成CH3OH或CO的百分比,如:CH3OH选择性=
n
(
C
H
3
OH
)
n
(
C
H
3
OH
)
+
n
(
CO
)
①如图3,240℃以上,随着温度升高,CO2的平衡转化率增大,而CH3OH的选择性降低。分析其原因:
升温,主反应的平衡逆向移动,而副反应的平衡正向移动且程度更大
升温,主反应的平衡逆向移动,而副反应的平衡正向移动且程度更大
。②如图4,温度为T1℃时,三条曲线几乎交于一点,分析其原因:
T1时以副反应为主,其反应前后气体分子数相等,改变压强对其平衡没有影响
T1时以副反应为主,其反应前后气体分子数相等,改变压强对其平衡没有影响
。③250℃时,在容积为VL的容器中,主反应和副反应均达到化学平衡,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下副反应的平衡常数为
1
60
1
60
(5)研究表明,在电解质水溶液中,Li-CO2电池中的CO2气体可被还原,而CO2在碱性介质中被还原为正丙醇 (CH3CH2CH2OH),其电极反应式为
3CO2+18e-+13H2O═CH3CH2CH2OH+18OH-
3CO2+18e-+13H2O═CH3CH2CH2OH+18OH-
。【答案】CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-187kJ/mol;CO、CH2O;*CO+*OH→*CO+*H2O;0.24mol/(L•min);<;升温,主反应的平衡逆向移动,而副反应的平衡正向移动且程度更大;T1时以副反应为主,其反应前后气体分子数相等,改变压强对其平衡没有影响;;3CO2+18e-+13H2O═CH3CH2CH2OH+18OH-
1
60
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/27 0:0:9组卷:26引用:1难度:0.4
相似题
-
1.肼(N2H4)可作为发射火箭的燃料。已知1g液态肼(N2H4)气体在空气中燃烧生成氮气和水蒸气,放出16.7kJ的热量,该反应的热化学方程式是( )
发布:2024/12/30 3:0:4组卷:121引用:9难度:0.6 -
2.氢在地球上主要以化合态的形式存在,是宇宙中分布最广泛的物质,它构成了宇宙质量的75%,属于二次能源.工业上生产氢的方式很多,常见的有水电解制氢,煤炭气化制氢,重油及天然气水蒸气催化制氢等.氢气是一种理想的绿色能源,如图1为氢能产生和利用的途径:
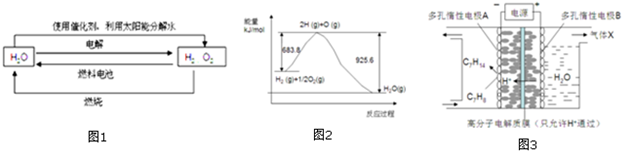
(1)图1的四个过程中能量转化形式有
A.2种 B.3种 C.4种 D.4种以上
(2)电解过程要消耗大量的电能,而使用微生物作催化剂在阳光下也能分解水.
2H2O(1)2H2(g)+O2(g)△H 1 2H2O(1)通电2H2(g)+O2(g)△H2光照催化剂
以上反应的△H1△H2(选填“<”、“>”或“=”)
(3)已知H2O(l)→H2O(g)△H=+44kJ.mol-1,依据图2能量变化写出氢气燃烧生产液态水的热化学方程式
(4)氢能利用需要选择合适的储氢材料.
①NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为
②镧镍合金在一定条件下可吸收氢气生产氢化物:LaNi3(s)+3H2(g)═LaNi3H6(s)△H<0,欲使LaNi3H6(s)释放出气态氢,根据平衡移动的原理,可改变的条件之一是
③一定条件下,如图3所示装置可实现有机物的电化学储氢,使C7H8转化为C7H14,则电解过程中产生的气体X 为,电极A上发生的电极反应式为.发布:2024/12/17 8:0:2组卷:38引用:1难度:0.5 -
3.在298K、1.01×105Pa下,将0.5mol CO2通入750mL 1mol•L-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知在该条件下,1mol CO2通入1L 2mol•L-1NaOH溶液中充分反应放出ykJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
发布:2024/12/30 4:0:1组卷:141引用:5难度:0.7


