鲁科版(2019)选择性必修1《2.3 化学反应的速率》2023年同步练习卷(9)
发布:2024/8/17 8:0:1
一、选择题
-
1.对于可逆反应A(g)+3B(g)⇌2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
组卷:21引用:2难度:0.9 -
2.H2O2分解速率受多种因素影响。实验测得 70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
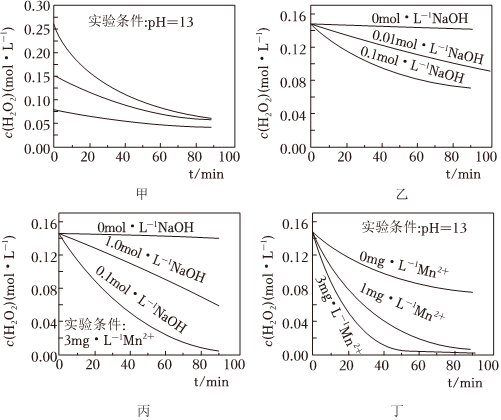 组卷:2340引用:67难度:0.7
组卷:2340引用:67难度:0.7 -
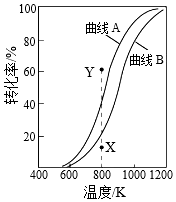 3.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
3.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)═2H2(g)+2CO(g)△H=+247.1kJ•mol-1
H2(g)+CO2(g)═H2O(g)+CO(g)△H=+41.2kJ•mol-1
在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法不正确的是( )组卷:53引用:8难度:0.7
三、多选题
-
9.温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)⇌2NO(g)+O2 (g) (正反应吸热)。实验测得:v正=v (NO2 )消耗=k正c2(NO2 ),v逆=v(NO)消耗=2v (O2 )消耗=k逆c2 (NO)•c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 物质的起始浓度(mol•L-1) 物质的平衡浓度(mol•L-1) c(NO2) c(NO) c(O2) c(O2) Ⅰ 0.6 0 0 0.2 Ⅱ 0.3 0.5 0.2 Ⅲ 0 0.5 0.35 组卷:607引用:9难度:0.5
四、实验题
-
10.研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
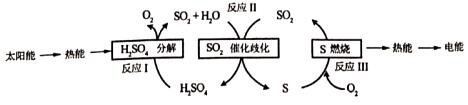
(1)反应Ⅰ:2H2SO4 (l)═2SO2(g)+2H2O(g)+O2(g)△H1=+551kJ•mol-1
反应Ⅲ:S(s)+O2(g)═SO2(g)△H3=-297kJ•mol-1
反应Ⅱ的热化学方程式。
(2)对于反应Ⅱ,在投料比【n(SO2):n(H2O)】为3:2时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图1所示。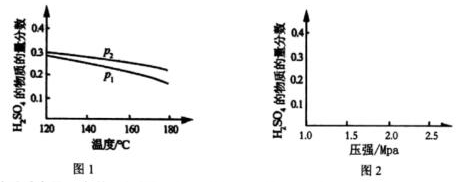
①下列说法不正确的是。
A.p2>pl
B.反应Ⅱ的△s<0
C.使用合适催化剂可以提高H2SO4在平衡体系中物质的量分数
D.其他条件相同时,投料比【n(SO2):n(H2O)】改变为2:1,可提高SO2的平衡转化率
②对于反应Ⅱ,在某一投料比时,分别为140℃和180℃下,在图2中画出H2SO4在平衡体系中物质的量分数随压强的变化关系示意图。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i.SO2+4I-+4H+═S↓+2I2+2H2O
ⅱ.I2+2H2O+SO2═SO42-+4H++2I-
为探究i、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18mL SO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①比较A、B、C,可得出的结论是序号 A B C D 试剂组成 0.4mol•L-1 KI 0.4mol•L-1 KI
0.2mol•L-1 H2SO40.2mol•L-1 H2SO4 0.2mol•L-1 KI
0.0002 mol I2实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较A快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 。
②实验表明,SO2的歧化反应速率D>A,结合i、ⅱ反应速率解释原因。组卷:83引用:4难度:0.5


