2023-2024学年广东省佛山市石门中学高二(上)开学化学试卷
发布:2024/9/1 1:0:8
一、选择题:本题共16小题,共44分。第1-10小题,每小题2分;第11-16小题,每小题2分。在每小题给出的四个选项中,只有一项是最符合题目要求的。
-
1.美好生活离不开化学知识的运用。下列有关叙述错误的是( )
组卷:19引用:1难度:0.7 -
2.“挖掘文物价值,讲好中国故事”。下列有关广东博物馆的镇馆之宝的叙述错误的是( )
组卷:21引用:1难度:0.8 -
3.建设美丽乡村,守护中华家园,衣食住行皆化学。下列说法正确的是( )
组卷:16引用:1难度:0.5 -
4.18世纪70年代瑞典化学家舍勒将软锰矿(主要成分为MnO2)和浓盐酸混合加热得到一种黄绿色气体——氯气。受此启发,某小组设计如下实验,能达到实验目的的是( )
组卷:88引用:2难度:0.6 -
5.劳动有利于“知行合一”,创造幸福生活。下列劳动项目与所述的化学知识没有关联的是( )
选项 劳动项目 化学知识 A 帮厨活动:帮家长炒菜,菜起锅前添加加碘食盐 碘酸钾是强电解质 B 环保行动:宣传使用聚碳酸酯制造的包装材料 聚碳酸酯在自然界可生物降解 C 家务劳动:用热纯碱溶液清除餐具和餐桌的油污 油脂在纯碱溶液中生成可溶物 D 学农活动:对作物施碳酸氢铵肥料时要深施覆盖 碳酸氢铵见光、受热都易分解 组卷:52引用:1难度:0.5 -
6.硅被誉为信息革命的“催化剂”。高纯硅的制备简易流程如图。下列叙述正确的是( )
 组卷:128引用:1难度:0.5
组卷:128引用:1难度:0.5
二、非选择题:本题共4小题,共56分。
-
19.某小组设计实验探究某常见金属M与硝酸反应。
实验(一)M与浓硝酸反应。
取金属M片和铜片在浓硝酸中构成原电池,如图1所示。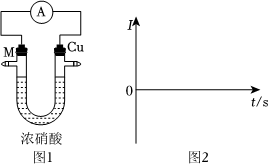
(1)步骤③中,b步骤 操作及现象 记录 ① 安装如图1装置,加入试剂进行反应,电流表指针偏转 电流强度(I)为a(a>0) ② 随着反应进行,电流表指针偏转角度减小 t1s时电流强度(I)为0 ③ 电流表指针向反方向偏转 电流强度(I)为b 0(填“>”“<”或“=”)。电流强度变化的原因是。
(2)步骤③中,负极的电极反应式为。符合条件的金属M除铁之外还有(填1种金属的化学式即可)。
(3)在如图2坐标系中绘制电流强度(Ⅰ)与时间关系的图象。
(4)若M为铁,探究铁极表面的物质组成。实验完毕,用蒸馏水清洗铁电极后,将该铁电极浸泡于盐酸中一段时间,将得到的溶液分成甲、乙两份,进行如表实验:
已知亚铁离子遇K3[Fe(CN)6]溶液会产生蓝色沉淀,则下列关于铁极表面的物质的推断合理的是实验 操作 现象 ⅰ 向甲中滴加NH4SCN溶液 无明显现象 ⅱ 向乙中滴加K3[Fe(CN)6]溶液 产生蓝色沉淀 (填字母)。
A.一定是Fe2O3
B.一定不含+3价铁
C.一定是FeO
D.可能是Fe3O4
实验(二)铁与极稀硝酸反应。
已知:FeSO4(aq)+NO(g)═Fe(NO)SO4(aq)(棕色)。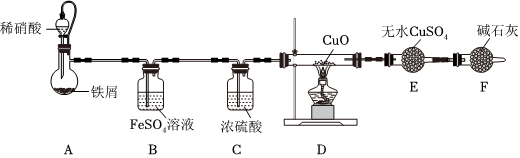
实验发现,装置B中溶液变棕色,装置D中黑色粉末变为红色,装置E中白色粉末变为蓝色。实验完毕后,取少量装置A中溶液,加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色。
(5)根据装置D、E现象可知,装置A中还原产物有(填化学式),产生该气体的原因是。
(6)假设上述实验生成三种还原产物且物质的量之比为1:1:1,11.2gFe完全反应转移0.6mol电子。写出该反应的离子方程式:。组卷:10引用:1难度:0.5 -
 20.亚硝酰溴(NOBr)常用于有机合成等。工业上,常用NO与Br2反应制取NOBr,其制备原理为2NO(g)+Br2(g)⇌2NOBr(g)。
20.亚硝酰溴(NOBr)常用于有机合成等。工业上,常用NO与Br2反应制取NOBr,其制备原理为2NO(g)+Br2(g)⇌2NOBr(g)。
(1)实验室常将液溴保存在水中,其原因是。实验室常用NaBr、MnO2和浓硫酸混合共热制备Br2,写出该反应的化学方程式:。
(2)在恒容恒温条件下,充入NO和Br2(g),发生上述反应。下列情况表明反应达到化学平衡状态的是(填字母)。
A.混合气体密度不随时间变化
B.混合气体压强不随时间变化
C.混合气体平均摩尔质量不随时间变化
D.生成NO速率等于消耗NOBr速率
(3)某条件下,该反应速率v=kca(NO)•cb(Br2)•cc(NOBr),其中k为速率常数,只与温度、催化剂有关,a、b、c为反应级数,可以取负数、正数;也可以取分数和整数。为了测定反应级数,实验结果如表:
①反应级数a为实验 c(NO)/mol•L-1 c(Br2)/mol•L-1 c(NOBr)/mol•L-1 反应速率 Ⅰ 0.1 0.1 0.1 v Ⅱ 0.2 0.1 0.1 4v Ⅲ 0.2 0.2 0.1 8v Ⅳ 0.4 0.2 0.2 16v 。
②其他条件相同,升高温度,k(填“增大”“减小”或“不变”)。
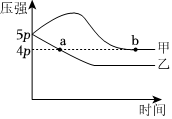
(4)在体积相同的甲、乙容器中均充入1molNO和1molBr2(g),在“恒温恒容”、“绝热恒容”条件下发生上述反应,测得压强与时间关系如图所示。提示:①绝热恒容指物质与能量与外界不交换,即对于放热反应,容器温度会升高;②对于恒温恒容条件下,气体总压强与气体总物质的量成正比例;③在体积相同的条件下,一定物质的量的气体,温度越高,压强越大。
①属于绝热恒容容器的是(填“甲”或“乙”),2NO(g)+Br2(g)⇌2NOBr(g)中反应物总能量(填“高于”或“低于”)产物总能量。气体总物质的量:n(a)n(b)(填“>”“<”或“=”)。
②a点NO的转化率为。组卷:13引用:1难度:0.5


