人教版(2019)选择性必修1《3.3.4 盐类水解的应用》2023年同步练习卷(10)
发布:2024/8/16 14:0:1
一、选择题
-
1.在Na2S溶液中下列关系不正确的是( )
组卷:30引用:11难度:0.7 -
2.下列关于0.10mol/L NaHCO3溶液的说法正确的是( )
组卷:65引用:8难度:0.7
三、解答题
-
16.磷的含氧酸及其盐是一类重要的化工产品,广泛用于食品、肥料、去油去污、防腐蚀、防锈、锅炉水处理等。请回答下列问题:
(1)次磷酸(H3PO2)是一种精细化工产品。向10mL 0.02mol•L-1 H3PO2溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子,则H3PO2是(填“一元酸”、“二元酸”或“三元酸”)。
(2)已知25℃时K(H3PO2)=1×10-2,该H3PO2溶液的pH为。
(3)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数K1=5.0×10-2、K2=2.6×10-3。
①电离常数K只与温度有关,当温度升高时,K值(填“增大”或“减小”)。
②试从电离平衡移动的角度解释K1、K2数据的差异:。
(4)25℃时,已知HF的电离常数K=3.6×10-4;H3PO4的电离常数K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为。组卷:27引用:3难度:0.5 -
17.研究硫元素及其化合物的性质具有重要意义。
(1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。[已知:Ksp(MnS)=2.8×10-13]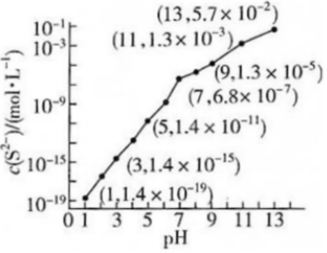
①pH=13时,溶液中的c(H2S)+c(HS-)=Ka1 Ka2 H2SO3 1.3×10-2 6.3×10-8 H2CO3 4.2×10-7 5.6×10-11 mol•L-1。
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=时,Mn2+开始沉淀。
(2)25℃,两种酸的电离平衡常数如表。H2SO3溶液和NaHCO3溶液反应的主要离子方程式为。
(3)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方向应用广泛:
①通常由NaHSO3过饱和溶液经结晶脱水制得Na2S2O5,写出该过程的化学方程式:。
②利用烟道气中的SO2生产Na2S2O5的工艺为: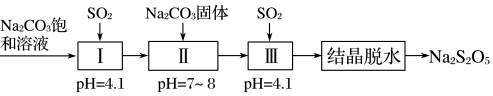
当pH=4.1时,Ⅰ中为溶液(写化学式),Ⅱ、Ⅲ的主要目的是。
③制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。电解后,(填“a”或“b”)室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。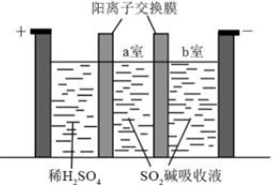 组卷:12引用:3难度:0.7
组卷:12引用:3难度:0.7


