研究硫元素及其化合物的性质具有重要意义。
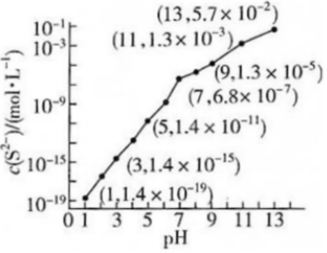
(1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。[已知:Ksp(MnS)=2.8×10-13]
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
0.043
0.043
mol•L-1。②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=
5
5
时,Mn2+开始沉淀。(2)25℃,两种酸的电离平衡常数如表。H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
H2SO3+HCO3-=HSO3-+CO2↑+H2O
H2SO3+HCO3-=HSO3-+CO2↑+H2O
。(3)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方向应用广泛:
①通常由NaHSO3过饱和溶液经结晶脱水制得Na2S2O5,写出该过程的化学方程式:
2NaHSO3=Na2S2O5+H2O
2NaHSO3=Na2S2O5+H2O
。②利用烟道气中的SO2生产Na2S2O5的工艺为:
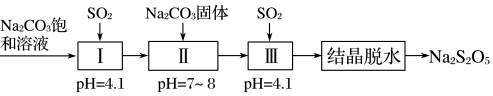
当pH=4.1时,Ⅰ中为
NaHSO3
NaHSO3
溶液(写化学式),Ⅱ、Ⅲ的主要目的是得到NaHSO3过饱和溶液
得到NaHSO3过饱和溶液
。③制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。电解后,
a
a
(填“a”或“b”)室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。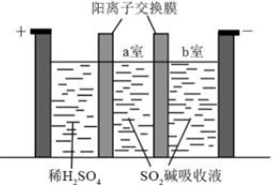
【考点】含硫物质的性质及综合应用.
【答案】0.043;5;H2SO3+HCO3-=HSO3-+CO2↑+H2O;2NaHSO3=Na2S2O5+H2O;NaHSO3;得到NaHSO3过饱和溶液;a
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 14:0:1组卷:12引用:3难度:0.7
相似题
-
1.下列说法不正确的是( )
发布:2024/12/30 15:0:1组卷:11引用:2难度:0.8 -
 2.硫俗称硫黄,主要存在于火山口附近或地壳的岩层中(如图),是一种黄色晶体,质脆易研成粉末,熔点为113℃,沸点为445℃,密度为2.06g/cm3。硫黄难溶于水,微溶于酒精、醚,易溶于二硫化碳。作为易燃固体,硫黄主要用于制造染料、农药、火柴、火药等。硫黄虽然是低毒性物质,但其燃烧后的气体对人体有致命的危害。
2.硫俗称硫黄,主要存在于火山口附近或地壳的岩层中(如图),是一种黄色晶体,质脆易研成粉末,熔点为113℃,沸点为445℃,密度为2.06g/cm3。硫黄难溶于水,微溶于酒精、醚,易溶于二硫化碳。作为易燃固体,硫黄主要用于制造染料、农药、火柴、火药等。硫黄虽然是低毒性物质,但其燃烧后的气体对人体有致命的危害。
(1)指出硫元素在元素周期表中的位置,硫元素的最高正价与最低负价分别是多少。
(2)从硫元素价态变化的角度分析,单质硫有哪些化学性质。
(3)如何用化学方法清洗试管内壁上附着的硫黄。写出反应的离子方程式。发布:2024/12/30 15:0:1组卷:6引用:2难度:0.7 -
3.下列说法正确的是( )
发布:2024/12/30 15:0:1组卷:4引用:2难度:0.8


