2023-2024学年广东省东莞市东华高级中学、东华松山湖高级中学高一(上)联考化学试卷(10月份)
发布:2024/9/11 7:0:8
一、单项选择题(共16小题,1-10每题3分;11-16每题4分;共54分)
-
1.“古诗文经典已融入中华民族的血脉”。下列诗文中隐含化学变化的是( )
组卷:6引用:1难度:0.8 -
2.下列说法正确的是( )
组卷:12引用:4难度:0.7 -
3.能用H++OH-═H2O来表示的化学反应是( )
组卷:49引用:1难度:0.8 -
4.下列叙述正确的是( )
组卷:4引用:2难度:0.8 -
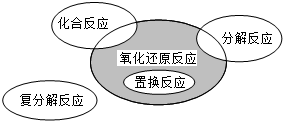 5.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )组卷:224引用:63难度:0.7
5.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )组卷:224引用:63难度:0.7 -
6.下列叙述正确的是( )
组卷:26引用:1难度:0.5 -
7.在能使石蕊变红的无色透明溶液中,能大量共存的离子组是( )
组卷:18引用:1难度:0.6
二、非选择题(共46分)
-
20.某溶液的溶质只可能由下列离子中的几种组成:Cl-、
、CO2-3、H+、Ba2-、Na+,某同学进行了如下实验:SO2-4
①向溶液中加入过量的BaCl2溶液,有白色沉淀生成,过滤;
②向①中滤液加入AgNO3溶液,有白色沉淀产生:
③将①的沉淀加入稀盐酸中,沉淀部分消失,有气体生成。
依据以上实验可以推断:
(1)原溶液中一定含有;一定没有。
(2)②中生成的沉淀是;③中反应的离子方程式是。
(3)写出NaHSO4在水溶液中的电离方程式:。
(4)书写离子方程式
①氢氧化铁和盐酸反应;
②向澄清石灰水中通入过量二氧化碳;
③写出BaCO3固体与足量的NaHSO4溶液反应的离子方程式:。组卷:59引用:1难度:0.5 -
21.亚硝酸钠(NaNO2)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究NaNO2的性质。
(1)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO+I2+2NaI+2H2O。用双线桥标出该反应的电子转移方向和数目:。
(2)NaNO2(填“是”或“不是”)电解质,根据NaNO2中N的化合价推测NaNO2具有(填“氧化性”、“还原性”或“氧化性和还原性”)。
(3)实验操作如表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
③通过上述实验可知,NaNO2、KMnO4、I2的氧化性由强到弱的顺序为实验 实验操作及现象或结果 结论 1 取5mL NaNO2溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 NaNO2具有① 2 取2mL KMnO4溶液(先酸化好)于试管中,滴加足量NaNO2溶液,可观察到的实验现象为② NaNO2具有还原性 3 NaNO2固体于70%硫酸反应生成NO和NO2两种气体 NaNO2具有氧化性和还原性 。
(4)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是。
A.亚硝酸钠是还原剂
B.维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子
D.亚硝酸钠被还原
②X与亚硝酸钠发生的反应可表示为2NaNO2+2X+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O(已配平),其中X是(填化学式),每生成1个I2,转移个电子。组卷:22引用:1难度:0.4


