2022-2023学年江苏省南京师大附中高一(下)期末化学试卷(A卷)
发布:2024/7/8 8:0:10
一、单项选择题:共16题,每题3分,共48分.每题只有一个选项最符合题意.
-
1.少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是( )
组卷:508引用:5难度:0.5 -
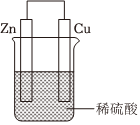 2.关于如图所示装置的叙述,正确的是( )组卷:25引用:3难度:0.5
2.关于如图所示装置的叙述,正确的是( )组卷:25引用:3难度:0.5 -
3.钢铁发生电化学腐蚀时,负极发生的反应是( )
组卷:16引用:2难度:0.9 -
4.下列有关金属冶炼的说法不正确的是( )
组卷:56引用:1难度:0.5 -
5.下列既属于氧化还原反应,又属于吸热反应的是( )
组卷:56引用:8难度:0.7 -
6.H2与O2发生反应的过程用模型图示如下(“-”表示化学键):下列说法不正确的是( )
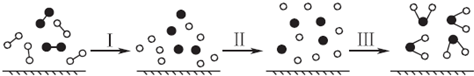 组卷:415引用:40难度:0.9
组卷:415引用:40难度:0.9
二、非选择题:共4题,共52分.
-
19.(1)CuCl可用作有机合成的催化剂。CuCl是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。
次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸,待CuH生成后将HCl气体通入,可产生CuCl。写出生成CuH的化学方程式:。
(2)某同学利用如图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。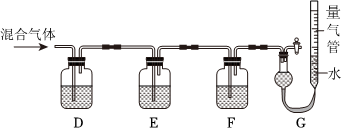
已知:i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl⋅H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
请回答以下问题:
G中测出的是(填物质的化学式)的体积。F洗气瓶中宜盛放的试剂是。
(3)工业上可以在酸性介质中用H2O2氧化浸出黄铜矿(CuFeS2)。
①CuFeS2反应后转化为Cu2+、Fe3+、。将1molCuFeS2完全转化,理论上所需H2O2的物质的量为SO2-4。
②浸出过程中发现,H2O2的反应实际用量远大于理论用量,原因是。
③若浸出过程中,溶液中含有少量Na2SO4,则会析出黄钠铁矾NaFe3(SO4)2(OH)6沉淀。写出Fe3+转化为黄钠铁矾沉淀的离子方程式:。组卷:17引用:1难度:0.5 -
20.氢能是一种重要能源,氢气的制备与储存是研究热点。
Ⅰ.一种电热化学循环制氢的方法如图所示,熔融电解质成分为K2CO3。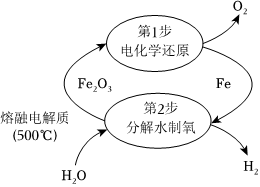
500℃时,Fe2O3能与熔融电解质发生反应:Fe2O3+CO2-32500℃+CO2↑,“电化学还原”步骤中,阴极的电极反应式为FeO-2。
Ⅱ.储氢的研究包括材料吸氢和脱氢的过程。LiBH4和MgH2都是氢容量(单位质量储氢材料储存H2的质量)较大的储氢材料。
(1)LiBH4、MgH2及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:
2LiBH4(s)=2LiH(s)+2B(s)+3H2(g)ΔH1=+207kJ⋅mol-1
MgH2(s)=Mg(s)+H2(g)ΔH2=+75kJ⋅mol-1
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)ΔH3=+184kJ⋅mol-1
①ΔH3<ΔH1+ΔH2的原因是。
②储氢材料脱氢的能量变化如图所示,三种材料中脱氢焓[ΔH(脱氢)]最小的是(填“LiBH4”、“MgH2”或“复合储氢材料”)。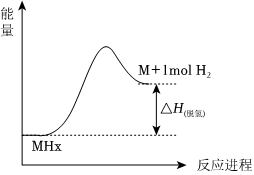
(2)Ti元素有+2、+3、+4等多种价态.向MgH2中添加适量Ti元素后可以加快其释放H2的速率,其机理示意图如图所示。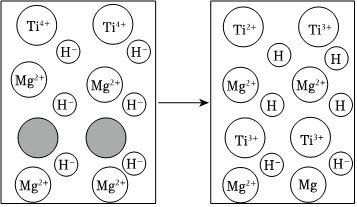
①图中 表示的微粒是 (用微粒符号表示)。
表示的微粒是 (用微粒符号表示)。
②MgH2释放H2速率加快的机理可描述为:、Mg2++2Ti2+=Mg+2Ti3+、(用方程式表示反应机理)。组卷:48引用:1难度:0.5


