2022-2023学年上海市建平中学高一(下)期末化学试卷
发布:2024/7/11 8:0:9
化学反应与能量变化
-
1.化学反应过程中,不仅有物质的变化,同时还伴随能量变化。研究化学反应中的能量变化有重要意义。
(1)下列反应中属于吸热反应的是。
A.氢气燃烧
B.铝粉和氧化铁粉末的反应
C.浓硫酸稀释
D.Ba(OH)2⋅8H2O和NH4Cl固体的反应
(2)已知充分燃烧1mol乙炔气体(分子式为C2H2)时生成二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是。
A.C2H2+O2=2CO2+H2O ΔH=-bkJ/mol52
B.2C2H2+5O2=4CO2+2H2O ΔH=-2bkJ/mol
C.C2H2(g)+O2(g)=2CO2(g)+H2O(l) ΔH=-bkJ/mol52
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=2bkJ/mol
(3)分别取40mL0.50mol/L的盐酸与40mL0.55mol/L的氢氧化钠溶液混合进行中和热的测定,下列说法正确的是。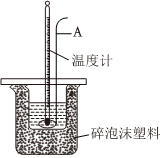
A.仪器A是金属搅拌棒
B.稍过量的氢氧化钠是确保盐酸完全反应
C.酸碱混合时,NaOH溶液应缓缓倒入小烧杯中,不断搅拌
D.用氢氧化钡和硫酸代替氢氧化钠和盐酸溶液,结果也是正确的
(4)下列说法正确的是。
A.焓变或熵变均可以单独作为反应自发性的判据
B.能自发进行的反应一定能迅速发生
C.ΔH<0、ΔS<0的反应在低温时能自发进行
D.两种物质反应,无论方程式的书写形式如何,ΔH均不变
(5)如图是某化学反应中的能量变化图。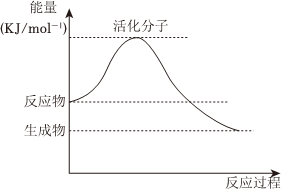
①该反应是(填“吸热”或“放热”)反应。
②请在图中标注出该反应的活化能E。
(6)298K,100KPa时,把1molH2和1molI2放在某密闭容器中进行反应,热化学方程式如下:H2(g)+I2(g)⇌2HI(g) ΔH=-9kJ/mol,测得反应放出的热量总是少于9kJ/mol,其原因是。组卷:61引用:1难度:0.5
氮、硫及其化合物
-
4.氮、硫及其化合物在工农业生产生活中有着重要作用,但对环境也有一定的危害。
(1)导致酸雨形成的气体主要是。
A.SO2
B.CO2
C.CO
D.CH4
(2)下列关于氮及其化合物的表述完全正确的是。
A.氮原子的核外电子轨道表示式: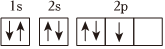
B.氨分子的球棍模型: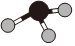
C.NH3•H2O的电离方程式:NH3•H2O=+OH-NH+4
D.氮气的结构式:
(3)将一定量锌与100mL18.5mol•L-1浓硫酸充分反应后,锌完全溶解同时产生气体1.5mol,将反应后的溶液稀释至1L,测得溶液c(H+)=0.1mol•L-1,则下列叙述中错误的是。
A.反应中生成的气体有SO2和H2
B.反应中共消耗锌97.5g
C.气体中SO2和H2物质的量之比为4:1
D.反应共转移电子3mol
工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH<0。
(4)书写该反应的平衡常数表达式K=。
(5)该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有(单选)。
A.改用高效催化剂
B.升高温度
C.缩小容器的体积
D.增加CH4的浓度
(6)在体积一定的容器中进行上述反应并达到平衡,保持其它条件不变,通入一定量的CH4,下列说法正确的是(不定项)。
A.正反应速率先增大后减小
B.混合气体的平均密度增大
C.化学平衡常数增大
D.达到新平衡时增大n(CH4)n(NO2)组卷:20引用:2难度:0.5
金属的性质
-
5.金属材料在人类社会发展中起到了举足轻重的作用,因为它具有比其他材料更优越的综合性能,能够更适应科技和生活方面提出的各种不同的要求。
(1)向滴有酚酞溶液的水中加入一块绿豆大的钠,下列实验现象描述错误的是。
A.钠沉入水底
B.钠熔成小球
C.发出“嘶嘶”声音
D.溶液变红
(2)我国自主研发的大飞机C919大量使用了铝锂合金。这是利用了铝锂合金的下列性质。
A.低强度
B.低密度
C.导热性
D.熔点低
(3)常温下,将铁片放到浓硫酸中,一段时间后。
A.溶液呈棕黄色
B.铁片质量减轻
C.有大量气泡产生
D.铁片表面生成致密氧化膜
(4)下列关于碳酸钠和碳酸氢钠的叙述正确的是。
A.相同条件下,在水中的溶解性:碳酸钠<碳酸氢钠
B.相同条件下,热稳定性:碳酸钠>碳酸氢钠
C.相同条件下,与酸反应的速率:碳酸钠>碳酸氢钠
D.一定条件下,碳酸钠不能转化为碳酸氢钠,而碳酸氢钠可以转化为碳酸钠
(5)实验室测定氧化物X(FexOy)的组成实验如图:
下列有关说法正确的是。
A.样品X中含有+2价铁元素0.01mol
B.溶液Y中c(Fe2+):c(Fe3+)=2:1
C.溶液Z中的离子只有Fe3+和Cl-
D.根据步骤Ⅰ、Ⅱ可判断X为Fe4O5
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(6)甲组同学通过研究pH对FeSO4稳定性的影响,得到如图1所示结果,增强Fe2+稳定性的措施为。
乙组同学为探究Fe2(SO4)3与Cu的反应,进行如图2所示实验: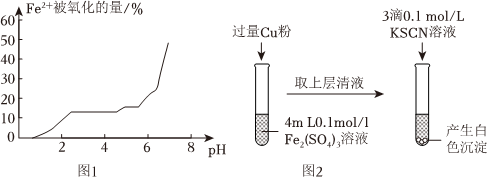
(7)Fe3+与Cu反应的离子方程式为。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2
实验方案如下:
(8)Cu2+与SCN-反应的离子方程式为实验方案 实验现象 步骤1:取FeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 无明显现象 步骤2:取CuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 产生白色沉淀 。
(9)FeSO4可用作补铁剂,使用时建议与维生素C同服。同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?实验方案 实验现象 取适量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 紫色褪去 (填“能”或“否”),请说明理由。组卷:27引用:1难度:0.5


