2022-2023学年山东省青岛市莱西市高二(上)期中化学试卷(学业水平一)
发布:2024/9/12 2:0:8
一、本大题共10小题,每小题2分,共20分。在每小题列出的四个选项中,只有一项符合题目要求。
-
1.在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析不正确的是( )
组卷:617引用:7难度:0.5 -
2.据报道,加拿大科学家发明了一种特殊的“电催化剂”,该新型“电催化剂”是一种用于电解器中催化水分解为氢气与氧气的多孔金属氧化物固体。下列有关该催化剂的说法正确的是( )
组卷:132引用:5难度:0.7 -
3.化学反应进行的方向是一个比较复杂的问题。下列有关说法正确的是( )
组卷:25引用:8难度:0.5 -
 4.z下列关于如图所示转化关系(X代表卤素)的说法不正确的是( )组卷:21引用:2难度:0.7
4.z下列关于如图所示转化关系(X代表卤素)的说法不正确的是( )组卷:21引用:2难度:0.7 -
5.某兴趣小组探究金属腐蚀条件,设计了以下实验装置。下列说法不正确的是( )
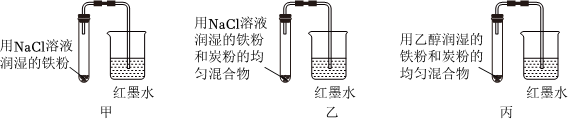 组卷:8引用:1难度:0.5
组卷:8引用:1难度:0.5 -
 6.工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家H•Moissan通过电解氟氢化钾(KHF2)的氟化氢无水溶液第一次制得氟气。已知:HF+HF═KHF2,制备氟气的电解装置如图所示。下列说法错误的是( )组卷:11引用:3难度:0.7
6.工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家H•Moissan通过电解氟氢化钾(KHF2)的氟化氢无水溶液第一次制得氟气。已知:HF+HF═KHF2,制备氟气的电解装置如图所示。下列说法错误的是( )组卷:11引用:3难度:0.7
三、非选择题,本题共5个小题,共60分。
-
19.二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:
已知:2SO2(g)+O2(g)⇌2SO3(g)ΔH=-196kJ•mol-1
(1)为研究该反应,某同学设计了如图所示的三种密闭容器装置(已装入固体V2O3催化剂)。
在初始体积与温度相同的条件下,甲、乙、丙三个容器中均按2molSO2、1molO2进行投料,达到平衡时,三个容器中SO2的转化率由大到小的顺序为(用“甲”“乙”“丙”表示)。
(2)在恒温恒压下不能说明该反应已达平衡的是(填序号)。
①v正(SO3)=2v逆(O2)
②n(SO3):n(O2):n(SO2)=2:1:2
③混合气体的平均相对分子质量不再改变
④氧气的平衡分压不再改变
(3)某温度,在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,t1时刻达到平衡,测得容器中含SO3(g)0.18mol。
①计算该温度下,平衡常数K=。
②t1时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是。
A.体积不变,向容器中通入少量氮气
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
③若继续通入0.02molSO3和0.010molO2,则平衡移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。
反应在5.0MPa、550℃时的α=。判断的依据是。组卷:8引用:1难度:0.5 -
20.我国力争2060年前实现碳中和。CH,与CO2催化重整是实现碳中和的热点研究课题。该催化重整反应体系主要涉及以下反应:
反应Ⅰ:主反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)ΔH1Kp1
反应Ⅱ:副反应CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2Kp2
反应Ⅲ:积碳反应2CO(g)⇌CO2(g)+C(s)ΔH3Kp3
反应Ⅳ:积碳反应CH4(g)⇌C(s)+2H2(g)ΔH4Kp4
(1)已知H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ•mol-1、-283.01kJ•mol-1,H2O(l)═H2O(g)ΔH5=+44kJ•mol-1,则反应Ⅱ的ΔH2=kJ•mol-1。
(2)下列关于该重整反应体系的说法正确的是。
A.在投料时适当增大的值,有利于减少积碳n(CO2)n(CH4)
B.在一定条件下建立平衡后,移去部分积碳,反应Ⅲ和反应Ⅳ平衡均向右移
C.随着投料比的增大,达到平衡时CH4的转化率增大n(CO2)n(CH4)
D.降低反应温度,反应Ⅰ、Ⅱ、Ⅳ的正反应速率减小,逆反应速率增大;反应Ⅲ的正反应速率增大,逆反应速率减小
(3)对于反应Ⅰ:主反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
①a点CO2转化率相等的原因是。
②在pMPa、900℃、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入催化剂密闭容器,CO2的平衡转化率α大于50%,解释说明原因,此时平衡常数。Kp=(以分压表示,分压=总压×物质的量分数:写出含α、n、p的计算表达式)。
(4)以NaCl饱和溶液为电解质溶液,利用如图所示的装置将CO2转化为燃料CO。则电极Ⅱ接电源的极,阴极上电极反应式为。 组卷:8引用:1难度:0.4
组卷:8引用:1难度:0.4


