2022-2023学年福建省泉州市永春一中高二(下)期末化学试卷
发布:2024/7/8 8:0:10
一.选择题(每题4分,共40分)
-
1.我国为人类科技发展作出巨大贡献.下列说法正确的是( )
组卷:51引用:3难度:0.7 -
2.Ca(OH)2与NH4Cl反应生成CaCl2、NH3和H2O。下列说法错误的是( )
组卷:30引用:6难度:0.7 -
3.LiAlH4是重要的还原剂,合成方法:NaAlH4+LiCl=LiAlH4+NaCl。下列说法正确的是( )
组卷:35引用:2难度:0.7 -
4.下列装置适用于实验室制氨,并验证其化学性质,其中能达到实验目的的是( )
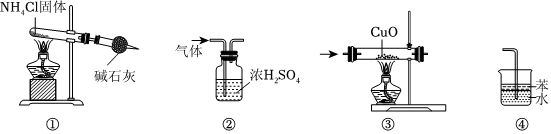 组卷:50引用:5难度:0.7
组卷:50引用:5难度:0.7 -
5.周期表中ⅥA族元素及其化合物应用广泛。用硫黄熏蒸中药材的传统由来已久;H2S是一种易燃的有毒气体(燃烧热为562.2kJ⋅mol-1),是制取多种硫化物的原料;硫酸、硫酸盐是重要化工原料;硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂。硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性Na2TeO3溶液制备Te。下列说法正确的是( )
组卷:34引用:3难度:0.7
二.非选择题(共60分)
-
14.CO2的资源化利用和转化已成为当今科学研究的热点。
(1)325℃时,水在Mn粉表面产生的H2可将CO2转化成甲酸,同时生成MnO。
①由H2O、Mn、CO2制备甲酸的化学方程式为。
②直接加热H2与CO2难以生成甲酸,该条件下能较快生成甲酸的原因是。
(2)CO2加氢生成CH3OH的主要反应的热化学方程式为
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH=-49.5kJ⋅mol-1
反应Ⅱ:H2(g)+CO2(g)=CO(g)+H2O(g)ΔH=41.2kJ⋅mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g)ΔH=-90.7kJ⋅mol-1
将n起始(CO2):n起始(H2)=1:3的混合气体置于密闭容器中,达到平衡时,体系中温度和压强对CH3OH的选择性影响如图所示。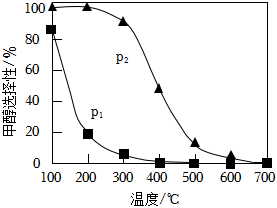
①压强的大小:p1p2(填“<”或“>”).
②CH3OH的选择性随温度升高而下降的原因是。
(3)CO2和环氧乙烷在MgO作催化剂的条件下合成碳酸乙烯酯。
①MgCl2溶液中加入尿素[CO(NH2)2]生成Mg5(CO3)4(OH)2沉淀,同时有CO2气体产生,该反应的离子方程式为。
②MgCl2与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到MgO。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是。
③MgO催化CO2合成碳酸乙烯酯(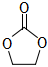 )可能的反应机理如图所示,根据元素电负性的变化规律,步骤Ⅰ、Ⅱ的过程可描述为 。
)可能的反应机理如图所示,根据元素电负性的变化规律,步骤Ⅰ、Ⅱ的过程可描述为 。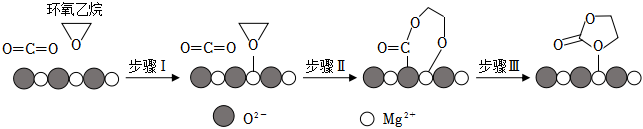 组卷:52引用:2难度:0.6
组卷:52引用:2难度:0.6 -
15.二甲醚(CH3OCH3)是一种极具发展潜力的有机化工产品和洁净燃料。CO2加氢制二甲醚的反应体系中,主要发生的热化学方程式为
反应Ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H=+41.2kJ•mol-1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.5kJ•mol-1
反应Ⅲ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
在2MPa,起始投料=3时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。n(H2)n(CO2)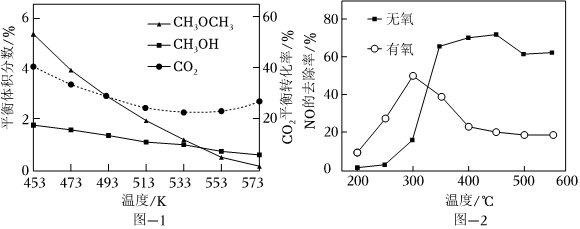
(1)2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=。
(2)从453~553℃,升高温度CO2平衡转化率降低的原因是。
(3)为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是。
在催化剂作用下,二甲醚还原NO的反应原理为CH3OCH3(g)+6NO(g)=3N2(g)+2CO2(g)+3H2O(g)△H<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
(4)无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是。
(5)温度高于400℃时,NO去除率明显低于无氧环境的可能原因有。组卷:12引用:1难度:0.6


