2022-2023学年辽宁省沈阳120中高二(下)期末化学试卷
发布:2024/8/9 8:0:9
一.选择题(每小题3分,共45分)
-
1.化学科学在国防装备的打造中发挥着重要作用,下列说法错误的是( )
组卷:17引用:1难度:0.7 -
2.下列各组物质的分类正确的是( )
①水煤气、冰醋酸、水玻璃、胆矾、干冰都是混合物
②含有氧元素的化合物叫氧化物
③CO2、NO2、P2O5均为酸性氧化物,Al2O3、CaO2为碱性氧化物
④同素异形体:C60、C70、金刚石、石墨
⑤强电解质溶液的导电能力一定强
⑥在熔化状态下能导电的化合物为离子化合物
⑦有单质参加的反应或有单质生成的反应是氧化还原反应组卷:220引用:1难度:0.6 -
3.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等物质的量的硫酸亚铁和硫酸铁的溶液混合,再滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径为36~55mm的磁流体。下列说法中正确的是( )
组卷:72引用:2难度:0.7 -
4.下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 条件 离子组 离子共存判断及反应的离子方程式 A 滴加氨水 Na+、Al3-、Cl-、NO3- 不能大量共存,
Al3++3OH-═Al(OH)3↓B 由水电离出的H+浓度为1×10-12mol•L-1 NH4+、Na+、NO3-、Cl- 一定能大量共存,NH4++H2O⇌MH3•H2O+H+ C pH=1的溶液 Fe2+、Al3+、SO42-、MnO4- 不能大量共存,5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O D 通入少量SO2气体 K+、Na+、ClO-、SO42- 不能大量共存,2ClO-+SO2+H2O═2HClO+SO32- 组卷:55引用:20难度:0.7 -
5.下列离子方程式表示正确的是( )
组卷:60引用:3难度:0.8 -
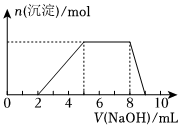 6.某溶液中可能含有如下离子:H+、Mg2+、Al3+、、Cl-、[Al(OH)4]-(不考虑水的电离)。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )NH+4组卷:43引用:4难度:0.5
6.某溶液中可能含有如下离子:H+、Mg2+、Al3+、、Cl-、[Al(OH)4]-(不考虑水的电离)。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )NH+4组卷:43引用:4难度:0.5
二.填空题(共55分)
-
18.硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在有机合成中被称为“万能还原剂”。制备硼氢化钠的流程如图1。
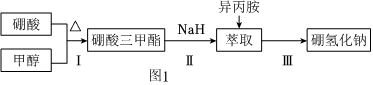
硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图2所示(夹持装置略去,下同)。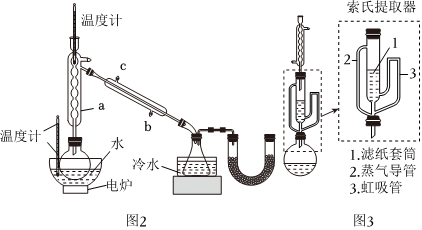
(1)直形冷凝管冷却水应从硼酸三甲酯B(OCH3)3 甲醇 甲醇钠 溶解性 与乙醇、甲醇混溶,能水解 与水混溶 溶于甲醇,不溶于异丙胺 沸点/℃ 68 64 450 硼酸三甲酯与甲醇混合物的共沸点为54℃ (填“b”或“c”)接口进入。
(2)浓硫酸的作用是。
(3)本实验采用水浴加热,优点是;U型管中试剂的作用是。
(4)在240℃条件下进行,硼酸三甲酯与氢化钠反应制取NaBH4,同时生成CH3ONa,写出该反应的化学方程式。
(5)萃取时可采用索氏提取法,其装置如图3所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。当萃取完全后,硼氢化钠在(填“圆底烧瓶”或“索氏提取器”)中。
(6)分离NaBH4并回收溶剂,采用的方法是。
(7)“有效氢含量”可用来衡量含氢还原剂的还原能力,定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为。(保留两位小数)组卷:49引用:2难度:0.5 -
19.一种抑制类杀菌剂H的合成路线如图:
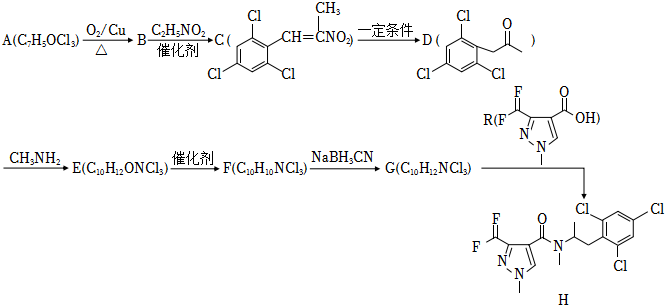
已知:
i:RCHI+CH3CH2NO2RCH=C(CH3)NO2催化剂
ii: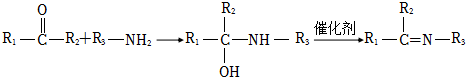
回答下列问题:
(1)A的名称为,G→H反应生成的官能团的名称为。
(2)反应A→B的化学方程式为。
(3)F的结构简式为。
(4)F→G的反应类型是。
(5)R的同分异构体中,满足下列条件的有种。
①能与FeCl3溶液发生显色反应;
②每1mol可消耗2molHCl;
③苯环上有6个取代基。
其中核磁共振氢谱峰面积之比为1:1:1的同分异构体的结构简式为。组卷:39引用:1难度:0.5


