2022-2023学年重庆市万州二中高二(上)月考化学试卷(12月份)
发布:2024/9/14 7:0:10
一、单选题(每个4分,共4×16==64分)
-
1.下列事实:
①NaHSO4溶液呈酸性;
②长期施用化肥(NH4)2SO4会使土壤酸性增强,发生板结;
③配制CuCl2溶液时,用稀盐酸溶解CuCl2固体;
④NaHS溶液中c(H2S)>c(S2-);
⑤明矾净水;
⑥蒸干FeCl3溶液,往往得不到FeCl3固体。
其中与盐类的水解有关的有( )组卷:14引用:2难度:0.7 -
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
组卷:65引用:6难度:0.5 -
3.下列有关实验内容、实验装置和对应的实验目的均正确的是( )
A B C D 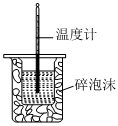
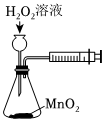
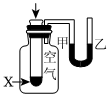
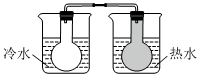
将NO2球浸泡在冷水和热水中测定中和热 测定O2的生成速率 验证反应的吸放热 比较温度对反应速率的影响 组卷:25引用:5难度:0.6 -
4.下列说法不正确的是( )
组卷:17引用:2难度:0.7 -
5.下列依据热化学方程式得出的结论正确的是( )
组卷:49引用:3难度:0.6 -
6.为达到相应实验目的,下列实验操作可行的是( )
编号 实验目的 实验操作 A 证明碳酸酸性强于硼酸 向饱和碳酸氢钠溶液中滴加少量的硼酸溶液,无气泡产生 B 证明HClO是弱电解质 用pH试纸测NaClO溶液的pH值 C 除去碱式滴定管内的气泡 将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出 D 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] 向10mL0.2mol•L-1NaOH溶液中滴入2滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl3溶液,出现红褐色沉淀 组卷:8引用:3难度:0.5
二、非选择题
-
17.(1)下列物质中,属于电解质的是
,属于强电解质的是,属于弱电解质的是(填序号)。
①H2SO4 ②盐酸 ③硫酸钡 ④乙醇 ⑤铜 ⑥H2S ⑦蔗糖 ⑧氨气 ⑨NH4HSO3
(2)甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式及平衡常数如下所示:
ⅰ.CO+2H2⇌CH3OH ΔH=akJ•mol-1 K1
ⅱ.CO+3H2⇌CH3OH+H2O ΔH=bkJ•mol-1 K2
ⅲ.CO+H2⇌CO+H2O ΔH=ckJ•mol-1 K3
回答下列问题:
①a═(用b、c表示),则K1═(用K2、K3表示)。
②在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2和H2,在催化剂的作用下仅发生反应ⅲ.下列叙述能表示该反应达到平衡状态的是(填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
(3)在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g)ΔH<0,如图为平衡时NO的体积分数与温度、压强的关系: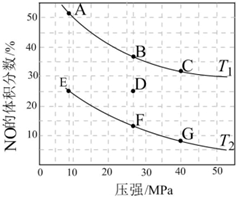
①温度:T1T2 (填“>”、“<”或“═”)。
②若在D点对应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点(填字母)。组卷:4引用:1难度:0.7 -
18.Na2SO3、NaHSO3是常见的化工原料,常用作还原剂。
(1)25℃,H2SO3、、HSO-3的物质的量分数[SO2-3]与pH的关系如图所示。n(某微粒)n(H2SO3)+n(HSO-3)+n(SO2-3)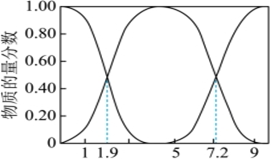
①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为时应停止通入。
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是(用溶液中所含微粒的物质的量浓度表示)。
③NaHSO3溶液的酸碱性:。
④若测得25℃时,某溶液中═10,则溶液的pH为c(SO2-3)c(H2SO3)。
(2)Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol•L-1I2标准溶液28mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000mol•L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+2Na2S2O3═2NaI+Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16mL。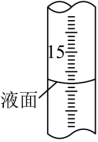
①如何判断滴定终点:。
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为mL。
③计算久置Na2SO3固体中Na2SO3的质量分数为。
④下列情况会造成样品中Na2SO3含量测定结果偏低的是(填序号)。
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数组卷:3引用:1难度:0.6


