(1)下列物质中,属于电解质的是 ①③⑥⑨①③⑥⑨,属于强电解质的是 ①③⑨①③⑨,属于弱电解质的是 ⑥⑥(填序号)。
①H2SO4 ②盐酸 ③硫酸钡 ④乙醇 ⑤铜 ⑥H2S ⑦蔗糖 ⑧氨气 ⑨NH4HSO3
(2)甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式及平衡常数如下所示:
ⅰ.CO+2H2⇌CH3OH ΔH=akJ•mol-1 K1
ⅱ.CO+3H2⇌CH3OH+H2O ΔH=bkJ•mol-1 K2
ⅲ.CO+H2⇌CO+H2O ΔH=ckJ•mol-1 K3
回答下列问题:
①a═b-cb-c(用b、c表示),则K1═K2K3K2K3(用K2、K3表示)。
②在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2和H2,在催化剂的作用下仅发生反应ⅲ.下列叙述能表示该反应达到平衡状态的是 dd(填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
(3)在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g)ΔH<0,如图为平衡时NO的体积分数与温度、压强的关系:
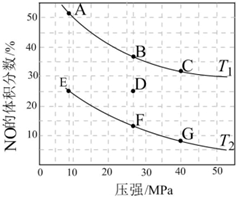
①温度:T1 >>T2 (填“>”、“<”或“═”)。
②若在D点对应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的 AA点(填字母)。
K
2
K
3
K
2
K
3
【答案】①③⑥⑨;①③⑨;⑥;b-c;;d;>;A
K
2
K
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/14 7:0:10组卷:4引用:1难度:0.7
相似题
-
 1.第五主族的磷单质及其化合物在工业上有广泛应用.
1.第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H已知相同条件下:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H12Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2SiO2(s)+CaO(s)=CaSiO3(s)△H3用△H1、△H2和△H3表示△H,则△H=;
(2)白磷与氧气反应生成P4O10固体.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图1的分子结构和有关数据通过计算写出该反应的热化学方程式为.
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如图2)之间脱去两个水分子产物,其结构式为,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为.
(4)次磷酸(H3PO2)为一元酸,分子中含一个羟基,其钠盐的正盐的化学式为,该盐可用于工业上的化学镀镍.①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)□Ni2++□H2PO2-+□=□Ni++□H2PO3-+□
(b)6H2PO-2+2H+=2P+4H2PO3-+3H2↑请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.原理上的不同点:;化学镀的优点:.发布:2024/11/19 8:0:1组卷:77引用:2难度:0.1 -
2.已知在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+O2(g)═SO2(g)+H2O(g) ΔH132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g) ΔH232
③H2S(g)+O2(g)═S(g)+H2O(g) ΔH312
④2S(g)═S2(g) ΔH4
则ΔH4的正确表达式为( )发布:2024/12/6 13:30:1组卷:393引用:6难度:0.5 -
3.氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.联氨(又称肼,N2H4或H2N-NH2,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为,其中氮的化合价为;
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,该反应中还原剂与氧化剂的物质的量之比为2:1,反应的化学方程式为.
(3)①2O2(g)+N2(g)═N2O4(g)△H1
②ON2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1038.6kJ•mol-1
上述反应热效应之间的关系式为△H4=,联氨和N2O4可作为火箭推进剂的主要原因为.
(4)联氨可用作火箭燃料,燃烧时发生的反应是N2O4(l)+2N2O4(l)═3N2(g)+4H2O(g)△H=-1038.6kJ•mol-1,若该反应中有4molN-H键断裂,则反应放出的热量为kJ.发布:2024/11/18 8:0:1组卷:12引用:0难度:0.9


