2022-2023学年广东省佛山市三水中学高二(上)第二次统测化学试卷
发布:2024/9/18 6:0:10
一、选择题(本题共16小题,共44分。1~10,每小题2分,共20分;11~16,每小题2分,共24分。每小题只有一个选项符合题意)
-
1.下列关于化学反应热效应的描述正确的是( )
组卷:20引用:3难度:0.6 -
2.下列事实能用勒夏特列原理来解释的是( )
组卷:118引用:28难度:0.7 -
3.关于下列各实验或装置的叙述中,正确的是( )
组卷:15引用:5难度:0.5 -
4.下列说法正确的是( )
组卷:55引用:7难度:0.8 -
5.室温下,若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
组卷:27引用:7难度:0.7 -
6.下列事实中一定能证明CH3COOH是弱电解质的是( )
①用CH3COOH溶液做导电实验,灯泡很暗
②0.1mol•L-1CH3COOH溶液的pH=2.1
③等pH等体积的硫酸、CH3COOH溶液和足量的锌反应,CH3COOH放出的氢气较多
④20mL0.2mol•L-1醋酸溶液恰好与20mL0.2mol•L-1NaOH溶液完全反应
⑤pH=1的CH3COOH溶液稀释至1000倍,pH<4组卷:108引用:4难度:0.6
二、非选择题(本题共4小题,共56分)
-
19.食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25℃时,HAc的Ka═1.75×10-5═10-4.76。
(1)某小组研究25℃下HAc电离平衡的影响因素。
提出假设。稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。
设计方案并完成实验。用浓度均为0.1mol/L的HAc和NaAc溶液,按下表配制总体积相同的系列溶液:测定pH,记录数据如下。
【表1】
①根据表中信息,补充数据:a═序号 V(HAc)/mL V(NaAc)/mL V(H2O)/mL n(NaAc):n(HAc) pH Ⅰ 40.00 / / 0 2.86 Ⅱ 4.00 / 36.00 0 3.36 ••• Ⅶ 4.00 a b 3:4 4.53 Ⅷ 4.00 4.00 32.00 1:1 4.65 ,b═。
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡(填“正”或“逆”)向移动:结合表中数据,给出判断理由:。
③由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。
实验结论假设成立。
(2)实验过程中,溶液浓度的准确性对结果会有影响,该小组同学认为应先用0.1000mol/L的NaOH溶液准确测定HAc溶液的浓度再验证,实验中:
①应选用作指示剂,判断到达滴定终点的实验现象是。
②下列操作会导致实验结果偏低的是。(填标号)
A.碱式滴定管未用标准NaOH溶液润洗
B.盛装未知液的锥形瓶用蒸馏水洗后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.滴定过程中振荡锥形瓶,液体不慎溅出
③某学生进行3次实验得到相关数据如下所示。
【表2】
则HAc的物质的量浓度为滴定次数 待测HAc的体积/mL 消耗0.1000mol/LNaOH溶液的体积/mL 滴定前读数 滴定后读数 第一次 25.00 0.00 28.13 第二次 25.00 1.56 32.30 第三次 25.00 0.22 28.29 mol/L(保留四位小数)。
(3)小组分析上【表1】数据发现:随着n(NaAc):n(HAc)的增加,c(H+)的值逐渐接近HAc的Ka。
查阅资料获悉:一定条件下,按n(NaAc):n(HAc)═1:1配制的溶液中,c(H+)的值等于HAc的Ka。
如果只有浓度均约为0.1mol/L的HAc和NaOH溶液,如何准确测定HAc的Ka?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
实验总结得到的结果与资料数据相符,方案可行。Ⅰ 移取20.00mLHAc溶液,用NaOH溶液滴定至终点,消耗NaOH溶液V1mL Ⅱ ,测得溶液的pH为4.76组卷:11引用:5难度:0.7 -
20.碳中和作为一种新型环保形式,目前已经被越来越多的大型活动和会议采用。回答下列有关问题:
(1)利用CO2合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1<0
Ⅱ.逆水汽变换:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2>0
Ⅲ.甲醇脱水:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)ΔH3>0
工艺2:利用CO2直接加氢合成CH3OCH3(反应Ⅳ)
①反应Ⅳ的热化学方程式为,平衡常数K4=(用K1、K3表示)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是。
A.气体物质中碳元素与碳元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内CH3OCH3浓度保持不变
(2)工艺1需先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。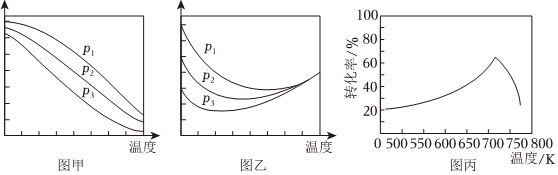
①下列说法正确的是。
A.图甲纵坐标表示CH3OH的平衡产率
B.p1<p2<p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,纵坐标为二氧化碳的平衡转化率,某温度时,三条曲线几乎交于一点的原因是。
(3)对于合成甲醇的反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH<0,一定条件下,单位时间内不同温度下测定的CO2转化率如图丙所示。温度高于710K时,随温度的升高CO2转化率降低的原因可能是。组卷:3引用:1难度:0.5


