人教版(2019)选择性必修1《3.3.2 影响盐类水解的主要因素 盐类水解的应用》2023年同步练习卷(5)
发布:2024/8/16 14:0:1
一、选择题
-
1.下列关于FeCl3水解的说法错误的是( )
组卷:48引用:8难度:0.7 -
2.在一定条件下,Na2CO3溶液存在水解平衡:
+H2O⇌CO2-3+OH-下列说法正确的是( )HCO-3组卷:187引用:68难度:0.7 -
3.下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂;
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂;
③草木灰与铵态氮肥不能混合施用;
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞;
⑤配制FeCl2溶液时加入少量铁粉。组卷:38引用:3难度:0.8 -
4.常温下,一定量的醋酸与氢氧化钠溶液发生中和反应.下列说法正确的是( )
组卷:110引用:19难度:0.9
二、解答题
-
13.(1)偏铝酸钠的水溶液呈
(填“酸”“中”或“碱”)性,原因是(用离子方程式表示):;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是(离子方程式表示)。
(3)用离子方程式表示泡沫灭火器灭火原理:。
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):。
(5)碳酸氢钠溶液中离子浓度由大到小的顺序是。组卷:7引用:2难度:0.6 -
14.NaClO溶液具有漂白能力,已知25℃时,Ka(HClO)=4.0×10-8,向含有NaOH的NaClO溶液中逐滴滴入FeSO4溶液,滴加过程中溶液的pH随FeSO4溶液的体积的变化曲线及实验现象见下表。
(1)NaClO的电子式是变化曲线 实验现象 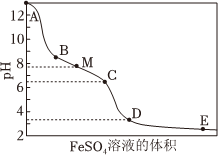
ⅰ.A→B产生红褐色沉淀
ⅱ.B→C红褐色沉淀的量增多
ⅲ.C→D红褐色沉淀的量增多
ⅳ.D点附近产生有刺激性气味的气体
ⅴ.D→E红褐色沉淀的量略有增多,次氯酸钠溶液中离子浓度大小顺序是:。
(2)下列关于NaClO溶液说法正确的是(双选)。
A.0.01mol/L溶液中,[ClO-]<0.01mol⋅L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O═+HClOHSO-3
D.25℃,pH=7.0的NaClO和HClO的混合溶液中,[ClO-]=[Na+]
(3)25℃,pH=7.0的NaClO和HClO的混合溶液中,[HClO][ClO-](填<,>或=)。
(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
ClO-+Fe2++□+H2O→Cl-+□。
①。
HClO+□+H2O→Cl-+□+□
②。
(5)已知H2CO3Ka1=4.4×10-7,Ka2=4.7×10-11,少量CO2通入NaClO溶液中发生的离子反应方程式为:。
向pH≈10的含硫废水中加入适量FeSO4溶液,产生黑色沉淀且溶液的pH降低。H2S、HS-、S2-在水溶液中的物质的量含物分数随pH的分布曲线如图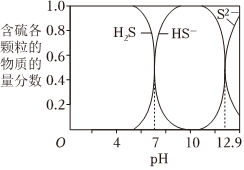
(6)水溶液中存在电离平衡H2S⇌H++HS-和HS-⇌H++S2-。下列关于H2S溶液的说法正确的是(单选)
A.滴加新制氯水,平衡向左移动,溶液pH减小
B.加水,平衡向右移动,溶液中氢离子浓度增大
C.通入过量SO2气体,平衡向左移动,溶液pH增大
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小
(7)pH≈10时,溶液中硫元素的主要存在形态为。
(8)用化学平衡移动原理解释向pH≈10的含硫废水中加入FeSO4溶液后pH降低的原因:。
(9)某温度下,CuS和Ag2S饱和溶液中pS和pM的关系如图所示,其中pS=-lg[S2-],pM=-lg[Mn+],Mn+为Cu2+或Ag+,下列说法错误的是(单选)。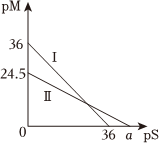
A.曲线Ⅱ代表的是Ag2S
B.a=49
C.此温度下CuS的Ksp=1×10-36
D.此温度下的饱和溶液中[CuS]>[Ag2S]组卷:111引用:3难度:0.5


