2023年北京五十五中高考化学保温试卷
发布:2024/6/3 8:0:1
一、选择题(共14小题,每小题3分,满分42分)
-
1.糖类、油脂、蛋白质是重要的营养物质,下列说法不正确的是( )
组卷:125引用:1难度:0.8 -
2.下列过程中,颜色变化与氧化还原反应无关的是( )
组卷:31引用:1难度:0.5 -
3.下列方程式与所给事实不相符的是( )
组卷:97引用:1难度:0.6 -
4.中国科学家经过光谱分析发现一颗锂元素含量极高的恒星。下列说法不正确的是( )
组卷:49引用:1难度:0.7 -
5.干冰(固态二氧化碳)在-8℃时可直接升华为气体,其晶胞结构如图所示。下列说法不正确的是( )
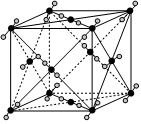 组卷:137引用:1难度:0.6
组卷:137引用:1难度:0.6 -
6.下列实验方案不能达到实验目的的是( )
选项 目的 实验方案 A 比较Mg、Al的金属性 向MgCl2、AlCl3溶液中分别加入过量NaOH溶液 B 鉴别KBr和KI溶液 将少量氯水分别滴入两溶液后,再加入少量CCl4 C 证明苯环对羟基的影响 分别向苯和苯酚溶液中滴加饱和溴水 D 比较苯酚和乙酸的酸性 测定相同温度与浓度时苯酚钠和乙酸钠的pH 组卷:23引用:1难度:0.5
二、填空题
-
18.氯化亚铜(CuCl)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产CuCl的工艺如图:
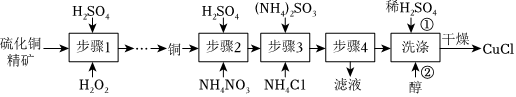
已知:CuCl难溶于醇和水,溶于c(Cl-)较大的体系[CuCl(s)+2Cl-⇌],潮湿空气中易水解氧化。CuCl2-3
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是。
(2)步骤2是溶解过程,溶解时反应的离子方程式。
(3)步骤3为主反应,Cu+的沉淀率与加入的NH4Cl的量关系如图所示。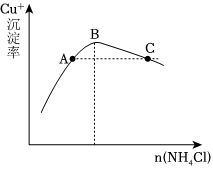
①反应的氧化产物是;
②比较c(Cu+)相对大小:A点C点(填“>”、“<”或“=”);
③提高C点状态混合物中Cu+沉淀率的措施是。
(4)步骤4进行的实验操作是。
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是。用乙醇洗涤的目的是。
(6)产品纯度测定:称取CuCl产品ag于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,然后用0.1000mol/LMnO4标准溶液滴定Fe2+,消耗KMnO4溶液bmL(本实验中的被还原为Mn2+,不与产品中杂质和Cl-反应)。MnO-4
①CuCl溶于Fe2(SO4)3溶液的离子方程式是。
②产品中CuCl(摩尔质量为99g/mol)的质量分数为。组卷:80引用:4难度:0.7 -
19.文献表明:相同条件下,草酸根(C2
的还原性强于Fe2+。为检验这一结论,完成如下实验。O2-4
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3]3-⇌Fe3++3C2K=6.3×10-21。O2-4
ⅲ.FeC2O4•2H2O为黄色固体,微溶于水,可溶于强酸。
【实验1】通过Fe3+和C2在溶液中的反应比较Fe2+和C2O2-4的还原性强弱。O2-4
(1)C2操作 现象 在避光处,向10mL0.5mol•L-1FeCl3溶液中缓慢加入0.5mol•L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 得到翠绿色溶液和翠绿色晶体 中碳元素的化合价是O2-4。
(2)取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是。
(3)经检验,翠绿色晶体为K3Fe(C2O4)3•3H2O。设计实验,确认实验1中没有发生氧化还原反应的操作和现象是。实验1中未发生氧化还原反应的原因是。
(4)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:[Fe(C2O4)3]3-+H2OFeC2O4•2H2O↓+光照+。
【实验2】通过比较H2O2与Fe2+、C2反应的难易,判断二者还原性的强弱。O2-4
(5)证明Fe2+被氧化的实验现象是步骤 操作 现象 Ⅰ 向1mL0.5mol•L-1FeSO4溶液中加入1mL0.5mol•L-1K2C2O4溶液,过滤 立即产生黄色沉淀 Ⅱ 洗涤Ⅰ中的黄色沉淀,向其中加入过量的6%H2O2溶液,振荡,静置 剧烈放热,产生大量的红褐色沉淀和无色气体 Ⅲ 待充分反应后,向其中加入稀硫酸,调节pH约为4 得到翠绿色溶液 。
(6)以上现象能否说明C2没有被氧化。请判断并说明理由:O2-4。
【实验3】通过其他实验方案比较Fe2+和C2的还原性强弱。O2-4
(7)用FeCl3溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2的还原性强弱。画出装置图并描述预期现象:O2-4。组卷:54引用:2难度:0.6


