2023-2024学年河北省秦皇岛市青龙实验中学高二(上)开学化学试卷
发布:2024/8/23 5:0:1
一、选择题(共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
-
1.陕西历史博物馆收藏和展出了陕西历史文化和中国古代文明中的诸多历史文物.以下文物的主要构成材料不是金属材料的是( )
组卷:23引用:3难度:0.7 -
2.化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是( )
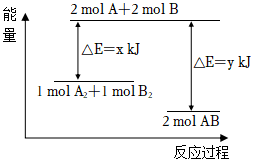 组卷:95引用:6难度:0.6
组卷:95引用:6难度:0.6 -
3.下列各组离子一定能大量共存的是( )
组卷:46引用:3难度:0.6 -
4.下列说法正确的是( )
组卷:46引用:4难度:0.9 -
5.下列关于氯水的叙述正确的是( )
组卷:70引用:1难度:0.5 -
6.有关 Fe2O3及硫酸盐的内容,以下叙述正确的是( )
组卷:12引用:2难度:0.7
三、填空题(本题包括4个小题,共58分)
-
17.含氮化合物的制备、应用及污染治理是科学研究领域的热点问题。试回答下列问题。
(1)反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g)ΔH=-620.9kJ•mol-1。可有效降低汽车尾气污染物的排放。
①对于该反应,下列说法正确的是(填序号)。
A.该反应在高温条件下可自发进行
B.容积固定的绝热容器中,温度保持不变时反应达到平衡状态
C.投料比[即]越大,NO转化率、反应速率均越大n(CO)n(NO)
D.在恒温恒压的容器中达平衡时,同时通入等物质的量的C•和CO2平衡不移动
②图中曲线表示在其他条件一定时反应速率与温度的关系,x为C•的转化率,其中最佳反应温度曲线为不同转化率下最大反应速率与温度的关系,则x最小的是下,理由是。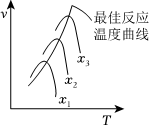
(2)我国科学家结合实验与计算机模拟结果,得到在铜催化作用下将一个N,N-二甲基甲酞胺[(CH3)2NCHO]转化为三甲胺[N(CH3)3]的合成路线。反应历程如图所示。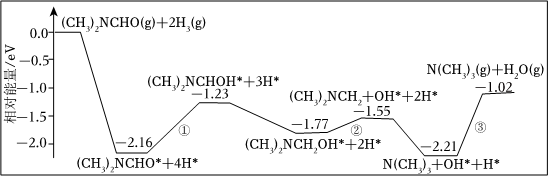
则反应( CH3)2NCHO(g)+2H2(g)═N(CH3)s(g)+H2O(g)的ΔH=kJ•mol-1(1eV=1.6×10-22kJ,NA的数值为6.02×1023,结果保留2位有效数字),①、②、③中反应速率最快的一步的化学方程式为。
(3)T℃时,存在如下平衡:2NO2(g)⇌N2O(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为v正=h正c2(NO2),v逆=k逆c(N2O4) (k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。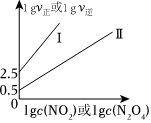
①图中表示lgv逆~lgc(N2O4)的线是(填“I”或“II”)。
②T℃时,该反应的平衡常数K=L/mol。
③T℃时,向2L恒容密闭容器中充入1.6molNO2,某时刻v正=4×100.5mol/(L•min),则此时NO2的转化率为。组卷:133引用:4难度:0.7 -
18.氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(1)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1077kJ/mol。已知相关反应的化学键键能数据如表:
则使1mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是化学键 N-H N-N N≡N O-H E/(kJ•mol-1) 390 190 946 460
(2)N2O4与NO2之间存在反应N2O4(g)⇌2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图1所示。
①由图推测该反应ΔH0(填“>”或“<”),理由为
②图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率一压强关系如图2所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=,在图2标出的点中,能表示反应达到平衡状态的点为。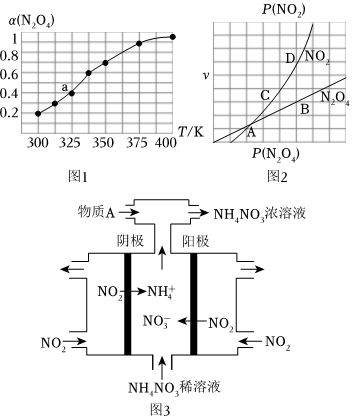
(3)电解NO2制备NH4NO3,其工作原理如图3所示。
①阳极的电极反应式为。
②为使电解产物全部转化为NH4NO3,需补充物质A,则A的化学式为。组卷:59引用:4难度:0.5


