2022-2023学年重庆市主城区七校高一(上)期末化学试卷
发布:2024/4/23 12:26:7
一、选择题(每题只有一个选项符合题意,每题3分,共48分)
-
 1.国家速滑馆是北京冬奥会最具科技含量的场馆,它采用了当前冬季运动场馆最环保的制冰技术之一——二氧化碳跨临界直接制冰技术。该技术通过压力变化使二氧化碳汽化实现制冷,产生的碳排放几近于零。下列说法中,不正确的是( )组卷:80引用:3难度:0.6
1.国家速滑馆是北京冬奥会最具科技含量的场馆,它采用了当前冬季运动场馆最环保的制冰技术之一——二氧化碳跨临界直接制冰技术。该技术通过压力变化使二氧化碳汽化实现制冷,产生的碳排放几近于零。下列说法中,不正确的是( )组卷:80引用:3难度:0.6 -
2.下列化学用语表述不正确的是( )
组卷:11引用:1难度:0.7 -
3.下列说法错误的是( )
组卷:97引用:2难度:0.6 -
4.碘是人体必需的微量元素之一。国家规定在食盐中添加碘的标准为20~30mg/kg。已知碘的一种核素是
I,则该原子的中子数是( )12753组卷:22引用:2难度:0.7 -
5.金属材料包括纯金属和它们的合金,合金在日常生活中有着广泛的应用。下列说法中不正确的是( )
组卷:26引用:2难度:0.7 -
6.化学与生活息息相关、密不可分。下列生活中的应用与所述的化学知识没有关联的是( )
选项 生活中的应用 化学知识 A 技术人员开发高端耐腐蚀镀铝钢板 铝能形成致密氧化膜 B ClO2可用于自来水的杀菌消毒 ClO2具有强氧化性 C 工人将模具干燥后再注入熔融钢水 铁与H2O高温下会反应 D 面包师用小苏打作发泡剂烘焙面包 Na2CO3可与酸反应 组卷:8引用:2难度:0.6
二、解答题(共4小题,满分52分)
-
19.Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途。
i.某小组同学依据性质差异,采用比较的方法设计实验鉴别Na2CO3和NaHCO3。
(1)实验Ⅰ中,分别向两支试管中滴加几滴水,A中温度计示数略有降低,B中温度计示数升高。说明固体b与水作用的过程中实验Ⅰ 实验Ⅱ 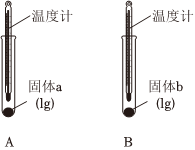
 (填“放出”或“吸收”)热量,可判断固体b为Na2CO3。
(填“放出”或“吸收”)热量,可判断固体b为Na2CO3。
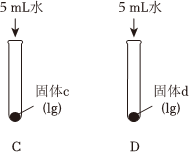
(2)实验Ⅱ中,向试管C和D中分别加入5mL水,充分振荡,试管C中固体有剩余,试管D中固体完全溶解。判断固体d为(填化学式)。
(3)25℃时,在10mL0.1mol⋅L-1Na2CO3溶液中逐滴加入0.1mol⋅L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(某微粒x的物质的量分数=×100%)变化如图所示。请写出OAB段的离子方程式c(x)c(H2CO3)+c(HCO3-)+c(CO32-)。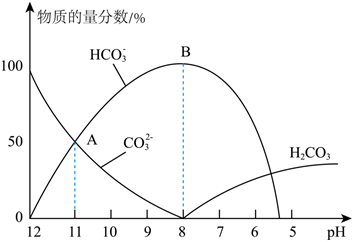
ii.实验室用Na2CO3固体配制500mL0.10mol/L的Na2CO3溶液,回答下列问题:
(4)称量的Na2CO3固体质量应为g。
(5)实验操作的正确顺序是。(填序号)
①将称量好的Na2CO3中加适量蒸馏水溶解在小烧杯中。
②将①所得溶液冷却到室温后,小心转入(填仪器名称)中。
③将容量瓶瓶塞塞紧,充分摇匀。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次。
⑤继续加蒸馏水至液面距刻度线1~2cm处,改用(填仪器名称),小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
(6)取出100mL配制好的溶液,加蒸馏水稀释至c(Na2CO3)=0.02mol/L。则稀释后溶液的体积为。
(7)下列操作会使所配溶液的物质的量浓度偏低的是。(填字母序号)
A.将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
B.定容时,俯视容量瓶上的刻度线
C.加水定容时,水量超过了刻度线
D.洗涤步骤中,洗涤液没有转入容量瓶组卷:50引用:2难度:0.7 -
20.已知物质间的转化关系如图所示(部分物质已省略)。A→B是实验室制取B单质的主要方法之一,B单质是黄绿色气体,以E为主要成分的合金是目前用量最大、用途最广的合金,H的焰色试验呈黄色,K是J与盐酸反应的产物。请完成下列填空。

(1)B和H的化学式为:B,H。
(2)用于检验K溶液中阳离子的试剂是,现象是。
(3)I转化为J的化学方程式为。
(4)湿法制备高铁酸钾K2FeO4的反应体系中有六种粒子:Fe(OH)3、、Cl-、ClO-、OH-、H2O。FeO2-4
①写出并配平湿法制高铁酸钾反应的离子方程式:。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为mol。组卷:12引用:2难度:0.5


