人教版(2019)选择性必修1《2.4 化学反应的调控》2023年同步练习卷(1)(2)
发布:2024/8/16 17:0:1
一、选择题
-
1.已知反应N2(g)+3H2(g)⇌2NH3(g)的ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
组卷:2引用:2难度:0.6 -
2.下列有关以H2和N2为原料气的工业合成氨反应的说法不正确的是( )
组卷:14引用:4难度:0.5 -
3.如图所示为工业合成氨的流程图。下列说法错误的是( )
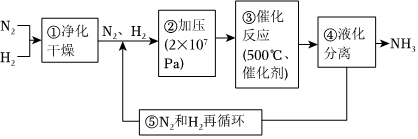 组卷:134引用:6难度:0.6
组卷:134引用:6难度:0.6 -
4.下列关于工业合成氨的叙述正确的是( )
组卷:208引用:5难度:0.7 -
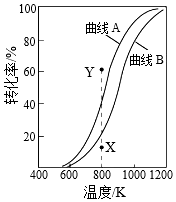 5.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
5.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)═2H2(g)+2CO(g)△H=+247.1kJ•mol-1
H2(g)+CO2(g)═H2O(g)+CO(g)△H=+41.2kJ•mol-1
在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法不正确的是( )组卷:53引用:8难度:0.7
四、解答题
-
16.合成氨工业的反应原理为N2+3H2
2NH3,合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。催化剂高温、高压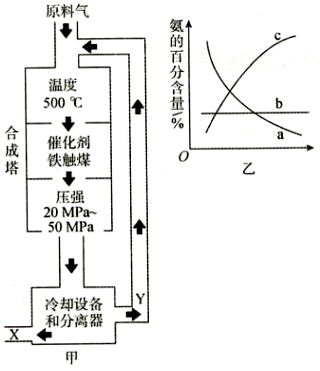
(1)X的化学式为。
(2)图甲中条件选定的主要原因是。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(3)改变反应条件,会使平衡发生移动。如图乙表示随条件改变,氨的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是,当横坐标为温度时,变化趋势正确的是。(填字母)组卷:6引用:2难度:0.7 -
 17.维持大气中CO2的平衡对生态环境保护有着重要意义。
17.维持大气中CO2的平衡对生态环境保护有着重要意义。
(1)CO2催化加氢合成低碳烯烃技术能有效利用大气中的CO2。
以合成C2H4为例,该转化分为两步进行:
第一步:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H1=+41.3kJ/mol
第二步:2CO(g)+4H2(g)⇌C2H4(g)+2H2O(g)△H2=-210.5kJ/mol
CO2加氢合成乙烯的热化学方程式为。
(2)CO2催化加氢在一定条件下还可以合成CH4.已知反应CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。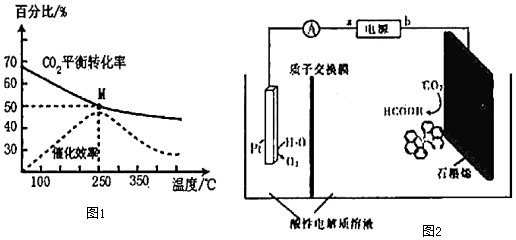
①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=MPa-2.(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×物质的量分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有(填字母)。
A.通入惰性气体
B.提高温度
C.增加二氧化碳浓度
D.增加氢气浓度
(3)利用铜基配合物l,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之一,其装置原理如图2所示。
电池工作过程中,图中Pt电极附近溶液的pH(填“变大”或“变小”),阴极的电极反应式为,每转移2mol电子,阴极室溶液质量增加g。组卷:17引用:2难度:0.5


