2022-2023学年上海市行知中学高一(下)期末化学试卷
发布:2024/7/8 8:0:10
-
1.化学在工业生产中以及环境治理中发挥了巨大作用,运用所学知识,回答下列问题。
(1)化学与社会、科学、技术、生活等密切相关,下列说法不正确的是。
A.大飞机C919采用了大量复合材料与铝锂合金,铝锂合金属于金属材料
B.汽车尾气的排放是形成光化学烟雾的主要原因之一
C.焦亚硫酸钠(Na2S2O5)长期放置会变成硫酸钠,故常添加在葡萄酒里作抗氧化剂
D.“华为麒麟990”手机芯片上的主要成分是二氧化硅
(2)如图为氨催化氧化的实验装置。实验过程中集气瓶中有白烟产生,该白烟可能是。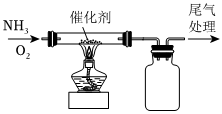
A.HNO3
B.NO2
C.NH4NO3
D.NH4Cl
(3)下列有关离子方程式书写正确的是。
A.FeO溶于稀HNO3:FeO+2H+═Fe2++H2O
B.吸收铜与浓硝酸反应后的尾气:2NO2+2OH-═+NO-2+H2ONO-3
C.Na2S与Na2SO3的混合溶液中加入盐酸:S2-++6H+═2S↓+3H2OSO2-3
D.向含有少量铜粉的KNO3溶液中加入稀硫酸:Cu+4H++2═Cu2++2NO2↑+2H2ONO-3
(4)向燃煤中加入适量石灰石(CaCO3),高温时将SO2转化为CaSO4的化学方程式是。
(5)以NaClO溶液作为吸收剂,一定条件下将SO2转化为的反应为放热反应。在图中画出该反应过程的能量变化SO2-4。
“脱硫”:将烟气与空气按一定比例通入含Fe2+的溶液中,其过程表示如下:
i:2Fe2++O2+SO2═2Fe3++SO2-4
ii:2H2O+2Fe3++SO2═2Fe2+++4H+SO2-4
(6)则“脱硫”过程的总反应离子方程式为。
土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:K2S+KNO3+H2O脱氧硫杆菌N2↑+K2SO4+KOH。
(7)配平上述反应方程式,并标出电子转移的方向和数目。
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的SO2、NO转化为:、SO2-4。当烟气中SO2和NO的体积比为2:1时,得到的吸收液中烟气转化生成的NO-3和Cl-的物质的量之比为NO-3。组卷:53引用:1难度:0.5
-
4.19世纪初,许多新的元素被相继发现,化学家开始关注这些元素在化学性质和物理性质上的相似性和递变性。1869年,俄国化学家门捷列夫编制了一份元素周期表,是化学发展史上的一个里程碑。
(1)我国导航卫星的“心脏”使用的是铷原子钟。其中铷的一种同位素原子符号为,通过该符号无法推断出的信息是8537Rb。
A.Rb元素的相对原子质量
B.Rb元素在周期表中的位置
C.Rb元素的原子序数
D.Rb元素的核外电子排布
(2)下列性质的比较,不能用元素周期律解释的是。
A.酸性:HClO4>H2SO4>H2SiO3
B.熔点:SiO2>CO2
C.热稳定性:H2O>H2S>SiH4
D.非金属性:F>O>N
(3)科学家利用四种原子序数依次递增的短周期主族元素W、X、Y、Z“组合”成一种超分子,该超分子具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是。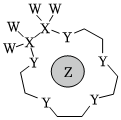
A.离子半径:Z<Y
B.与H2化合的难易程度:Y<X
C.Z与Y可组成多种离子化合物
D.Z元素对应离子的氧化性在同周期元素中最强
四种短周期元素W、X、Y、Z的核电荷数依次增大,它们的相关信息如下表。
完成下列填空:元素 W X Y Z 相关信息 原子得到1个电子后达到稀有气体稳定结构 质子数为6,中子数为8的一种核素,常用于测定文物年代 其气态氢化物极易溶于水 原子最外层电子是最内层电子的2倍
(4)W所形成的负离子的电子式为。
(5)用于测定文物年代的X核素的符号为。
(6)Z在元素周期表中的位置是,试比较元素X与Z的简单氢化物稳定性由大到小的顺序是(用化学式表示)。
(7)通过如图装置可以比较X、Y、Z三种元素的非金属性强弱。已知硅酸是一种不溶于水的白色物质,则溶液Ⅰ的溶质是(填化学式);进行实验时溶液Ⅲ中的现象是。有人认为上述装置存在缺陷,无法达到实验目的,请写出改进的措施。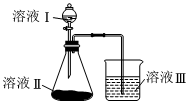 组卷:48引用:1难度:0.5
组卷:48引用:1难度:0.5 -
5.有机化合物不仅与人类的衣、食、住、行密切相关,而且还是揭示生命现象及其规律的钥匙。运用所学知识,回答下列问题。
(1)下列对有机物的认识,说法正确的是。
A.甲基的电子式为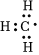
B.烷烃分子中所有原子共平面
C.乙烯的球棍模型为
D.合成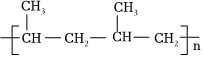 的单体有2种
的单体有2种
(2)烷烃CH3CH2CH(CH3)2可由某炔烃加氢获得,关于该炔烃的说法错误的是。
A.名称为2-甲基-3-丁炔
B.和乙炔互为同系物
C.可以使酸性高锰酸钾溶液褪色
D.加聚产物在一定条件下能导电
(3)有人认为CH4是四棱锥形,碳原子位于四棱锥的顶点(如图),判断CH4不是四棱锥形分子的依据是。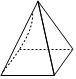
A.CH4分子中碳氢键的夹角均为109°28′
B.一氯甲烷只有一种结构
C.二氯甲烷只有一种沸点
D.CH4中碳的质量分数75%
工业上由煤炭出发制取有机化工原料乙炔,流程如图。回答以下问题:
(4)实验室用电石(CaC2)来制备乙炔,反应的化学方程式为:。乙炔是一种稍有气味的气体,但实验室制备的乙炔气体具有令人厌恶的气味,可用某种溶液进行检验,写出检验此气体的化学方程式:。
(5)导电高分子是以聚乙炔为载体的高聚物,写出反应Ⅱ的化学方程式:。
(6)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。ETFE(填“有”、“没有”)固定熔沸点,其结构简式为:。
(7)如图为篮烷的键线式,假设篮烷分子中键角只有135°、90°两种,则它的一氯代物有种(不考虑立体异构)。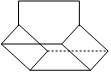
(8)2-甲基-1,3-丁二烯属于共轭二烯烃,可以发生Diels-Alder反应,转化关系如图所示(-R1、-R2、-R3、-R4为不同的烃基)。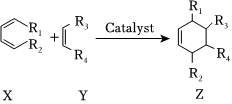
写出乙炔和2-甲基-1,3-丁二烯发生上述反应的生成物的键线式。组卷:36引用:1难度:0.5


