2023年江苏省扬州市江都区邵樊片区中考化学二模试卷
发布:2024/6/4 8:0:5
一、选择题,本题包括20小题,每小题2分,共计40分。每小题只有一个选项符合题意。
-
1.“绿水青山,就是金山银山”。守护碧水蓝天,我们在行动。下列标志属于中国环境标志的是( )
组卷:6引用:1难度:0.8 -
2.“春江花都,与水为邻,这里每一轮朝阳都水粼粼”。清澈的河水属于( )
组卷:5引用:2难度:0.5 -
3.下列能量变化不是由化学变化引起的是( )
组卷:43引用:2难度:0.5 -
4.物质是由微粒构成的。下列物质由原子构成的是( )
组卷:22引用:5难度:0.6 -
5.扬州的本土茶以绿杨春茶为主,茶叶中含有较丰富的氟,这里的氟是指( )
组卷:29引用:2难度:0.7 -
6.《周礼•考工记》中记载将木头烧成灰(主要成分为K2CO3),浸泡灰汁,再加入熟石灰,以制取KOH漂洗丝帛。其中制取KOH的反应的类型为( )
组卷:29引用:5难度:0.7 -
7.下列不能与稀硫酸反应的金属是( )
组卷:26引用:3难度:0.6 -
8.下列实验现象,正确的是( )
组卷:60引用:7难度:0.7
二、非选择题(共60分)
-
24.Co3O4可应用于磁性材料等领域,实验室利用乙酸钴晶体[Co(CH3COO)2•4H2O)]制备Co3O4的步骤如下:
Ⅰ、将乙酸钴晶体配制成溶液X,缓慢滴加(NH4)2CO3溶液,30℃水浴加热一段时间。
Ⅱ、将混合液高压密封加热到160℃,得到含碱式碳酸钴晶体的浊液。
Ⅲ、制备碱式碳酸钴晶体。
Ⅳ、将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
【资料卡片】:
①碱式碳酸钴晶体不溶于冷水和乙醇,易溶于温水,常压下高于30℃开始分解。
②+2的Co易被空气中的氧气氧化为+3。
(1)步骤1中配制的“溶液X”为100g溶质质量分数为17.7%的乙酸钴溶液,则需乙酸钴晶体的质量为g,溶解时,玻璃棒的作用是。
(2)30℃水浴的装置如图所示,温度计应置于处(填“a”或“b”)。
(3)步骤Ⅱ中加热时采用高压密封的目的分别是、。
(4)步骤Ⅲ中由步骤Ⅱ的浊液制备碱式碳酸钴的主要步骤有:冷却至室温,→用蒸馏水洗涤→用乙醇洗涤→低温干燥。“用乙醇洗涤”优点是,这是利用了乙醇的。
(5)Co3O4中钴元素既有+2价又有+3价,若改写为mCo2O3•nCoO,则m:n为。
(6)步骤Ⅳ煅烧碱式碳酸钴过程中发生的反应方程式为:6[2CoCO3•3Co(OH)2•H2O]+5O210Co3O4+12CO2↑+24H2O煅烧
①乙酸俗称醋酸,化学式为CH3COOH。试分析在由乙酸钴晶体制备碱式碳酸钴的过程中钴元素的化合价(填“升高”或“不变”或“降低”)。
②若在煅烧时通入的氧气过多,则会使产品中钴元素的质量分数(填“偏大”或“不变”或“偏小”)。
③将钴粉末在温度不高于890℃的空气中焙烧氧化,也可制得四氧化三钴,写出反应的方程式。组卷:25引用:2难度:0.5 -
25.高纯氧化铁(Fe2O3)又称“引火铁”,在现代工业上有广泛应用前景。以下是用赤铁矿(含少量不溶于水的SiO2等)为原料,制备高纯氧化铁的生产流程示意图,请回答相关问题。
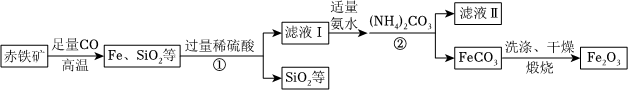
【资料卡片】:
①氨水呈碱性(主要成分NH3•H2O是一种碱);(NH4)2CO3溶液呈碱性,40℃以上易分解。
②FeCO3FeO+CO2↑,4FeO+O2=2Fe2O3高温
(1)赤铁矿炼铁的方程式为。
(2)加适量氨水的目的是。
(3)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是。
(4)滤液Ⅱ中可回收的产品是(写化学式),该物质的用途是。
(5)有同学认为可以向滤液Ⅰ中通入CO2和NH3也能实现同样反应。某学习小组利用如图装置模拟此反应。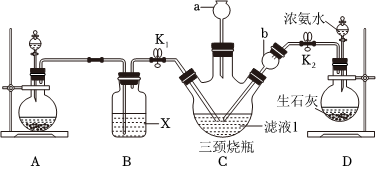
①图A为实验室制备CO2的装置,其药品的最佳选择为(填序号)。
A.石灰石
B.CaCO3
C.稀盐酸
D.稀硫酸
②B装置为除去二氧化碳中的氯化氢气体,洗气瓶中的试剂X可选择(填序号)。
A.NaOH溶液
B.饱和NaHCO3溶液
C.AgNO3溶液
D.浓硫酸
③C装置中长颈漏斗a的作用是,在其上端需要放一团沾有酸液的棉花团其原因是,长颈漏斗b的作用是。
(6)写出在空气中煅烧FeCO3的化学反应方程式。
(7)该流程中使用稀硫酸的质量分数为19.6%,若用含Fe2O380%的赤铁矿1.5t作为原料,则理论上参加反应的稀硫酸的质量是多少?(写出计算过程)组卷:43引用:2难度:0.4


