人教版(2019)选择性必修1《第3章 水溶液中的离子反应与平衡》2023年单元测试卷
发布:2024/8/16 11:0:4
一、选择题
-
1.下列说法正确的是( )
组卷:43引用:2难度:0.5 -
2.升高温度,下列数据不一定增大的是( )
组卷:43引用:8难度:0.9 -
3.25℃时将水不断滴入0.1mol/L的氨水中,下列变化的图象合理的是( )
组卷:27引用:2难度:0.6 -
4.能证明乙酸是弱酸的实验事实是( )
组卷:2025引用:27难度:0.9 -
5.H2S2O3是一种弱酸,实验室欲用0.01mol•L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
组卷:323引用:19难度:0.9 -
6.某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH.其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka•Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7组卷:123引用:6难度:0.5
三、解答题
-
 19.Ⅰ.常温下,浓度均为0.1 mol•L-1的六种溶液的pH如表所示:
19.Ⅰ.常温下,浓度均为0.1 mol•L-1的六种溶液的pH如表所示:
请回答下列问题:溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN Na2SO4 pH 8.8 9.7 11.6 10.3 11.1 7.0
(1)上述六种溶液中,水的电离程度最小的是(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是(填写一种物质即可)。
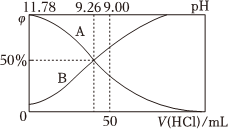
Ⅱ.常温下,向100 mL 0.2 mol•L-1的氨水中逐滴加入0.2 mol•L-1的盐酸,所得溶液的pH、溶液中和NH3•H2O的物质的量分数与加入盐酸的体积的关系如图所示。NH+4
(3)根据图象回答下列问题。
①表示NH3•H2O浓度变化的曲线是(填“A”或“B”)。
②NH3•H2O的电离常数为。
③当加入盐酸体积为50 mL时,溶液中c()-c(NH3•H2O)═NH+4mol•L-1(用数字表示)。
Ⅲ.已知:Ag++SCN-═AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(4)称取2.000 g制备的硝酸银样品,加水溶解,定容到100 mL.溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有。
(5)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol•L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为。终点时消耗标准溶液25mL,硝酸银样品纯度为。组卷:101引用:4难度:0.5 -
20.铁及其化合物在生活和工业生产中被广泛应用.
Ⅰ.氯化铁溶液常用作印刷电路铜板蚀刻液.请回答下列问题:
(1)将FeCl3溶液蒸干、灼烧后,得到的主要固体产物是(写化学式).
(2)常温下,若向某FeCl3溶液中加入一定量的澄清石灰水,调节溶液pH为4时,可得到红褐色沉淀,则溶液中Fe3+的物质的量浓度c(Fe3+)=mol/L.(已知:Ksp[Fe(OH)3]=2.8×10-39)
(3)用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有Fe3+、Fe2+和Cu2+,某探究小组设计如图实验方案处理FeCl3溶液蚀刻铜板后的废液和资源回收.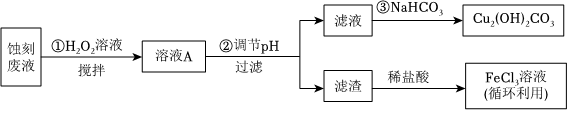
某些金属阳离子生成氢氧化物沉淀的pH如表所示:
①根据表中数据推测,步骤②应调节pH的范围是物质 Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀pH 4.2 5.8 1.2 完全沉淀pH 6.7 8.3 3.2 ≤pH<.
②若步骤②中加入CuO调节pH,则反应的离子方程式为.
Ⅱ.双极膜(BP)是一种在直流电的作用下,能将水分子解离为H+和OH-的特殊离子交换膜.应用双极膜制取聚合硫酸铁净水剂[Fe2(OH)n(SO4)3-0.5n]m(简称PFS)的电化学装置如图所示,甲、乙表示H+或OH-.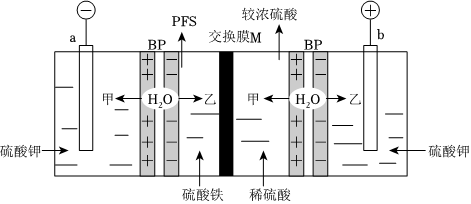
(1)a、b均为石墨电极,b极的电极反应式为.
(2)M为(填“阳”或“阴”)离子交换膜.
(3)电流密度过大,会使PFS产品的纯度降低,可能的原因是.组卷:21引用:2难度:0.4


