2022-2023学年河北省石家庄市高一(下)期末化学试卷
发布:2024/8/2 8:0:9
一、单项选择题(本题共20小题,每小题2分,共40分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
-
1.航天服的材料主要是由碳化硅和其它材料复合而成。下列有关说法正确的是( )
组卷:17引用:1难度:0.7 -
2.生活中的一些问题常常涉及化学知识。下列说法错误的是( )
组卷:20引用:1难度:0.8 -
3.下列化学用语表达错误的是( )
组卷:14引用:1难度:0.7 -
4.下列关于化学反应中的能量变化说法正确的是( )
组卷:27引用:1难度:0.5 -
5.下列关于硫酸及硫酸盐的说法错误的是( )
组卷:18引用:1难度:0.6 -
6.烷烃及卤代泾是重要的有机化工原料,下列有关说法正确的是( )
组卷:64引用:1难度:0.5 -
7.用灼烧法证明海带中含有碘元素,各步骤选用的实验用品不必都用到( )
实验步骤 实验用品 A 步骤1:将海带灼烧灰化 
B 步骤2:将海带灰溶解、过滤 
C 步骤3:氧化滤液中的I- 
D 步骤4:检验碘元素  组卷:327引用:7难度:0.9
组卷:327引用:7难度:0.9 -
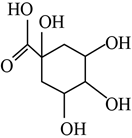 8.某有机物的结构简式如图所示,下列说法错误的是( )组卷:17引用:3难度:0.7
8.某有机物的结构简式如图所示,下列说法错误的是( )组卷:17引用:3难度:0.7
二、填空题(本题包括5小题、共60分)
-
 24.研究化学反应进行的快慢和程度,有利于更好地利用化学反应为人类服务。
24.研究化学反应进行的快慢和程度,有利于更好地利用化学反应为人类服务。
Ⅰ.实验探究影响化学反应速率的因素
反应原理:Na2S2O3+H2SO4-Na2SO4++S↓+H2O
实验步骤如下表:
(1)将化学方程式补充完整:Na2S2O3+H2SO4═Na2SO4+编号 温度℃ 加入0.1mol/LNa2S2O3溶液的体积/mL 加入水的体积/mL 加入0.1mol/LH2SO4溶液的体积/mL 出现浑浊的时间/s 1 25 2 0 2 t1 2 25 1 a 2 t2 3 45 2 0 2 t3 +S↓+H2O。
(2)a=;t1、t2、t3从大到小的顺序为。
Ⅱ.速率、平衡理论在碳循环中的应用
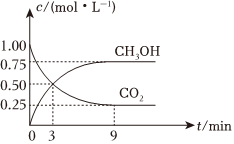
CO2可转化成有机物从而实现碳循环。在体积为1L的密闭容器中,充入1molCO2(g)和3molH2(g),一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),此反应为放热反应。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
(3)3~9min内,v(H2)=mol⋅L-1⋅min-1。
(4)实验测得不同时刻容器内n(CH3OH)的数值如下表所示:
反应最快的时间段为时间/min 1 3 6 9 12 n(CH3OH)/mol 0.10 0.50 0.70 0.75 0.75 (填选项字母);解释其原因为。
A.0~1min
B.1~3min
C.3~6min
D.6~9min
(5)能说明上述反应达到平衡状态的是(填选项字母)。
A.反应中CO2(g)与CH3OH(g)的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3molH2(g),同时生成1molH2O(g)
D.CO2的体积分数在混合气体中保持不变
(6)平衡时,CO2(g)的转化率为。组卷:18引用:1难度:0.5 -
25.氮是自然界各种生命活动不可缺少的重要元素。
Ⅰ.自然界中氮的循环(如图所示)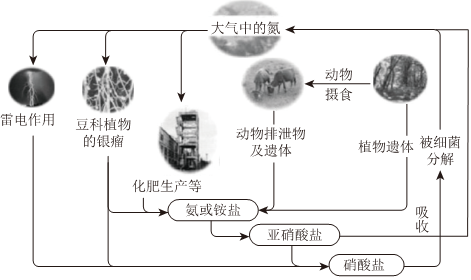
(1)豆科植物的根瘤进行固氮的过程属于(填“化学”或“物理)变化;通过雷电作用进行固氮过程中,第一步反应的化学方程式为。
(2)某氮肥厂产生的氨氮废水中的氮元素多以和NH3⋅H2O的形式存在,设计如图处理流程:NH+4
①过程I:加NaOH溶液,调节pH至9后,升温至30℃,通入空气将氨赶出并回收。加入NaOH溶液时,所发生反应的离子方程式为。
②过程Ⅱ:在微生物作用下实现的转化,称为硝化过程。在碱性条件下,NH+4→NO-2→NO-3被氧气氧化为NH+4的总反应的离子方程式为NO-3。
Ⅱ.实验室制氨气
(3)实验室制备氨气可以选择A或B装置,如果选择A装置,则发生反应的化学方程式为;如果选择B装置,则分液漏斗中盛装的物质为(填名称);干燥氨气时,可选用的干燥剂为;收集氨气采用法。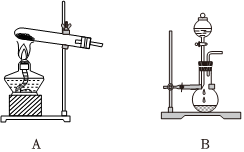
Ⅲ.浓硝酸和稀硝酸氧化性强弱比较
(4)按如图所示装置进行实验(加持装置已略去),实验证明浓硝酸的氧化性强于稀硝酸,依据为浓硝酸能将NO氧化为NO2,而稀硝酸不能。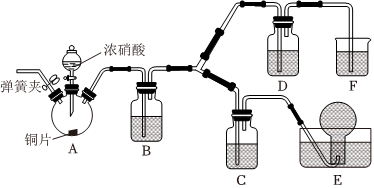
已知:NaOH溶液不与NO反应,能与NO2反应。
①浓硝酸应保存在棕色试剂瓶中,用化学方程式解释其原因为。
②装置A中发生反应的化学方程式为;装置B的作用为。
③装置D中的现象为;C中盛放的试剂为。组卷:44引用:1难度:0.6


