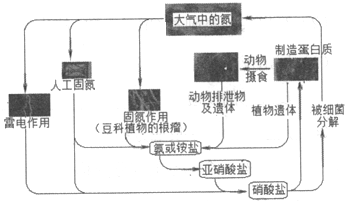
氮是自然界各种生命活动不可缺少的重要元素。
Ⅰ.自然界中氮的循环(如图所示)
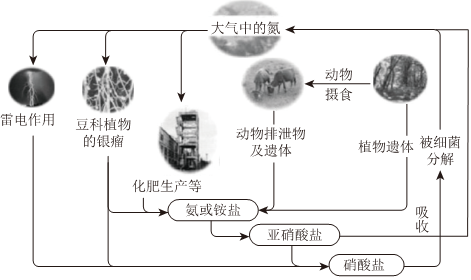
(1)豆科植物的根瘤进行固氮的过程属于 化学化学(填“化学”或“物理)变化;通过雷电作用进行固氮过程中,第一步反应的化学方程式为 N2+O2 放电 2NON2+O2 放电 2NO。
(2)某氮肥厂产生的氨氮废水中的氮元素多以NH+4和NH3⋅H2O的形式存在,设计如图处理流程:

①过程I:加NaOH溶液,调节pH至9后,升温至30℃,通入空气将氨赶出并回收。加入NaOH溶液时,所发生反应的离子方程式为 NH+4+OH- △ NH3+H2ONH+4+OH- △ NH3+H2O。
②过程Ⅱ:在微生物作用下实现NH+4→NO-2→NO-3的转化,称为硝化过程。在碱性条件下,NH+4被氧气氧化为NO-3的总反应的离子方程式为 NH+4+2OH-+2O2=NO-3+3H2ONH+4+2OH-+2O2=NO-3+3H2O。
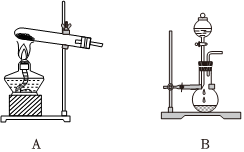
Ⅱ.实验室制氨气
(3)实验室制备氨气可以选择A或B装置,如果选择A装置,则发生反应的化学方程式为 Ca(OH)2+2NH4Cl △ CaCl2+2NH3↑+2H2OCa(OH)2+2NH4Cl △ CaCl2+2NH3↑+2H2O;如果选择B装置,则分液漏斗中盛装的物质为 浓氨水浓氨水(填名称);干燥氨气时,可选用的干燥剂为 碱石灰或氢氧化钠碱石灰或氢氧化钠;收集氨气采用 向下排空气法向下排空气法法。
Ⅲ.浓硝酸和稀硝酸氧化性强弱比较
(4)按如图所示装置进行实验(加持装置已略去),实验证明浓硝酸的氧化性强于稀硝酸,依据为浓硝酸能将NO氧化为NO2,而稀硝酸不能。
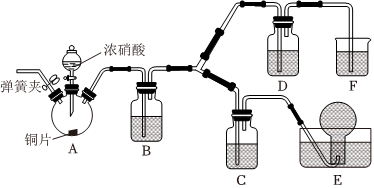
已知:NaOH溶液不与NO反应,能与NO2反应。
①浓硝酸应保存在棕色试剂瓶中,用化学方程式解释其原因为 4HNO3 光照 4NO2↑+O2↑+2H2O4HNO3 光照 4NO2↑+O2↑+2H2O。
②装置A中发生反应的化学方程式为 Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2OCu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;装置B的作用为 将NO2转化为NO将NO2转化为NO。
③装置D中的现象为 液面上方气体由无色变为红棕色液面上方气体由无色变为红棕色;C中盛放的试剂为 稀硝酸稀硝酸。
放电
放电
N
H
+
4
NH
+
4
△
NH
+
4
△
N
H
+
4
→
N
O
-
2
→
N
O
-
3
N
H
+
4
N
O
-
3
N
H
+
4
N
O
-
3
N
H
+
4
N
O
-
3
△
△
光照
光照
【考点】含氮物质的综合应用.
【答案】化学;N2+O2 2NO;+OH- NH3+H2O;+2OH-+2O2=+3H2O;Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O;浓氨水;碱石灰或氢氧化钠;向下排空气法;4HNO3 4NO2↑+O2↑+2H2O;Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;将NO2转化为NO;液面上方气体由无色变为红棕色;稀硝酸
放电
NH
+
4
△
N
H
+
4
N
O
-
3
△
光照
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/2 8:0:9组卷:44引用:1难度:0.6
相似题
-
1.硫和氮及其化合物在生产生活中应用广泛,含氮氧化物和硫氧化物的尾气需处理后才能排放。请回答下列问题:
(1)稀硫酸、稀硝酸与铜粉反应制胆矾晶体,过程中生成一种无色气体,该气体是(填化学式),制得的胆矾晶体中可能存在的杂质是(填名称)。
(2)Na2SO3是实验室重要的常见药品,有一瓶放置了很久,小明同学想设计一个实验验证这瓶药品是否变质。请你帮助他设计一个实验。
(3)一种NH3催化还原NO的物质转化如图所示。若参与反应的NH3和O2物质的量之比为4:1,写出转化时总反应的化学方程式:。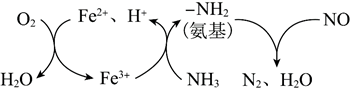
(4)利用氨水可以将SO2和NO2吸收,原理如图所示: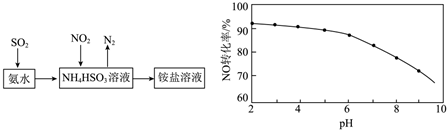
NO2被吸收的离子方程式是。
(5)在酸性NaClO溶液中,HClO氧化NO生成Cl-和。其他条件相同,NO转化为NO-3的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是NO-3。发布:2024/12/30 3:30:1组卷:56引用:1难度:0.5 -
2.下列关于自然界中氮循环(如图)的说法不正确的是( )
 发布:2024/12/30 4:0:1组卷:141引用:2难度:0.9
发布:2024/12/30 4:0:1组卷:141引用:2难度:0.9 -
3.下列关于氮的氧化物的说法中正确的是( )
发布:2024/12/30 6:0:2组卷:28引用:2难度:0.5


