2022-2023学年湖北省问津联合体高二(上)质检化学试卷(10月份)
发布:2024/6/4 8:0:5
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
-
1.下列说法正确的是( )
组卷:39引用:2难度:0.8 -
2.下列关于化学反应速率的说法正确的是( )
①恒温时,增大压强,化学反应速率一定加快
②其他条件不变,温度越高,化学反应速率越快
③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量
④3mol•L-1•s-1的反应速率一定比1mol•L-1•s-1的反应速率大
⑤有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加单位体积内活化分子数,从而使反应速率增大
⑥增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多组卷:229引用:17难度:0.9 -
3.下列有关说法正确的是( )
组卷:13引用:3难度:0.7 -
4.在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)→pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是( )
①体系的温度不再改变
②各组分的浓度相等
③各组分的质量分数不再改变
④反应速率v(A):v(B)=m:n
⑤n⋅v正(A)=m⋅v逆(B)
⑥体系气体的平均相对分子质量不再改变组卷:7引用:4难度:0.5 -
5.在其他条件不变时,只改变某一条件,化学反应aA(g)+bB(g)⇌cC(g)的平衡的变化图象如图(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是( )
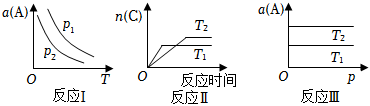 组卷:47引用:6难度:0.6
组卷:47引用:6难度:0.6 -
6.下列能用来描述可逆反应2A(g)+B(g)⇌2C(g)ΔH>0的图象是( )
组卷:50引用:7难度:0.5
二、非选择题(共分55)
-
18.在10L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)
其化学平衡常数K与温度t的关系如下表:
请回答:t(℃) 700 800 830 1000 1200 K 0.6 0.9 1.0 1.7 2.6
(1)该反应为(填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K=。保持温度和体积不变,充入一定量的CO2,则平衡常数。(填“增大”、“减小”或“不变”)
(3)下列措施可以提高H2的转化率的是(填选项序号)。
a.选择适当的催化剂
b.增大压强
c.及时分离H2O(g)
d.升高温度
(4)某温度下,c(CO2)=2mol/L,c(H2)=3mol/L,开始反应,达到平衡时CO2转化率为60%,则平衡常数K=。
(5)与(4)相同的温度下,某时刻测得c(CO2)=0.5mol/L,c(H2)=1.5mol/L,c(CO)=0.5mol/L、c(H2O)=0.5mol/L,则此时反应是否达到平衡状态(填“是”或“否”)。此时,v(正)v(逆)(填“>”、“<”或“=”)。
(6)该反应的反应速率 (v) 随时间 (t) 变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)。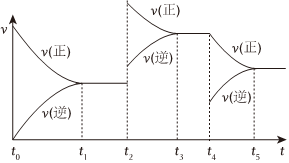
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t4时,采取的措施可以是增加CO2的浓度。
d.在t5时,容器内CO的体积分数是整个过程中的最大值组卷:163引用:4难度:0.6 -
19.用CO2转化为乙醇可实现碳循环,近年来,随着全球变暖及能源枯竭的加剧,由CO2制乙醇又再次成为各国的研究热点。
Ⅰ.(1)CO2转化为乙醇的一种途径如下:
2CO2+2H2O(1)═C2H4(g)+3O2(g)ΔH1=+1411.0kJ⋅mol-1
C2H4(g)+H2O(l)⇌C2H5OH(l)ΔH2=-44.2kJ⋅mol-1
则2CO2(g)+3H2O(1)⇌C2H5OH(1)+3O2(g)ΔH=kJ⋅mol-1。
Ⅱ.已知CO2催化加氢制乙醇原理为2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g),回答下列问题:
(2)在恒温恒容的密闭容器中,对CO2催化加氢制乙醇反应体系说法错误的。(填序号)
A.增大原料气中的比例,有利于提高CO2的转化率n(CO2)n(H2)
B.若混合气体的密度保持不变,说明反应体系已达平衡
C.体系达平衡后,若压缩容器容积,则反应平衡正向移动
(3)在均为2L的恒容密闭容器a和b中分别投入2molCO2和6molH2,在不同温度下进行CO2加氢制乙醇的反应,各容器中乙醇的物质的量与时间的关系如图所示: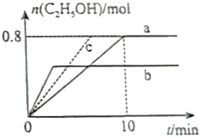
①容器a中0~10min氢气的平均反应速率v(H2)=;
②若容器a、b中的反应温度分别为T1、T2,则判断ΔH0(填“>”或“<);
③若容器a中改变条件时,反应情况会由曲线a变为曲线c,则改变的单一条件可是(填序号);
A.加入更高效的催化剂
B.升温
C.增大压强
D.分离出乙醇
④T1温度下反应达平衡时,容器a中气体总压强为4MPa,则T1时该反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,气体的分压=气体总压强×气体的物质的量分数)。
(4)虽然由CO2催化加氢制乙醇目前还无法实现产业化,但该方法具有很多优点、具有广阔的综合利用前景,试说明原因(任写一个原因):。组卷:8引用:1难度:0.5


