2022-2023学年福建省福州一中高二(上)期末化学试卷
发布:2024/6/25 8:0:9
一、选择题(本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的)
-
1.下列反应属于吸热反应的是( )
组卷:97引用:3难度:0.7 -
2.我国科研团队研制出以KSn合金为负极的可充电K-CO2电池,放电反应为4KSn+3CO2=2K2CO3+C+4Sn,下列说法不正确的是( )
组卷:35引用:3难度:0.7 -
3.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
组卷:66引用:4难度:0.7 -
4.下列事实不能用勒夏特列原理解释的是( )
组卷:92引用:3难度:0.7 -
5.已知25℃时,Ka(HClO)=4.0×10-8。下列说法不正确的是( )
组卷:46引用:1难度:0.7 -
6.化学与人类生活、生产息息相关。下列说法不正确的是( )
组卷:20引用:1难度:0.6 -
7.对下列图示实验的描述正确的是( )
选项 实验装置图 相关描述 A 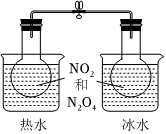
根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)⇌N2O4(g)正反应是吸热反应 B 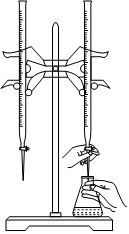
用已知浓度的NaOH溶液滴定锥形瓶中未知浓度的盐酸 C 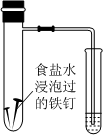
根据小试管中液面的变化判断铁钉发生吸氧腐蚀 D 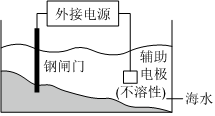
该保护金属的方法为牺牲阳极法 组卷:20引用:3难度:0.7
二、非选择题(本题共5小题,每空2分,共52分)
-
20.C元素是组成化合物种类最多的元素,含C元素的酸有也多种,其中氢氰酸(HCN)和草酸(H2C2O4)是两种比较特殊的酸。
(1)氢氰酸有剧毒,25℃时,该酸的电离常数为Ka=6.2×10-10。
①25℃时KCN溶液中CN-的水解常数Kh==c(HCN)×c(OH-)c(CN-)(保留一位小数)。
②0.2mol⋅L-1的KOH溶液与0.4mol⋅L-1的HCN溶液等体积混合后,恢复到25℃,混合溶液中c(K+)和c(HCN)浓度大小关系是c(K+)c(HCN)(填“>”、“<”或“=”)。
(2)为测定某草酸晶体产品中H2C2O4⋅2H2O的质量分数,称取14.00g产品溶于水,配制成500mL溶液,用浓度为0.1000mol⋅L-1的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表。已知2+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,杂质不与高锰酸钾反应,H2C2O4⋅2H2O相对分子质量为126。MnO-4
①滴定终点的现象是:当最后半滴KMnO4溶液滴入时,实验次数 第一次 第二次 第三次 消耗KMnO4溶液体积/mL 20.05 19.95 24.36 。
②通过实验数据,计算该产品中H2C2O4⋅2H2O的质量分数为。
③下列操作会导致测定结果偏低的是。
A.锥形瓶用待测液润洗
B.装酸性高锰酸钾溶液的滴定管没有润洗
C.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视,滴定结束时俯视组卷:29引用:1难度:0.7 -
21.已知25℃时,几种常见弱酸的Ka如表所示:
(1)25℃时,0.1mol⋅L-1的①NaCN②CH3COONa③Na2CO3溶液的pH由大到小的顺序是电解质 H2C2O4 CH3COOH HCN H2CO3 HClO 电离常数 Ka1=5.9×10-2
Ka2=6.4×10-5K=1.7×10-5 K=6.2×10-10 Ka1=4.5×10-7
Ka2=4.8×10-11K=2.9×10-8 (填序号)。
(2)25℃时,用0.10mol⋅L-1KOH溶液滴定10.00mL0.10mol⋅L-1H2C2O4溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
①当V<10mL时,反应的离子方程式为。
②当V=10mL时,所得溶液中c(H2C2O4)、c(HC2)和c(C2O-4)由大到小排列的顺序依次为O2-4。
③当V=20mL时,所得溶液中c(K+)=。(填物料守恒式)。
④如图5点所示溶液中,水的电离程度最大的是(填序号)。
(3)已知:Ksp(AgI)=8.5×10-17;Ksp(AgCl)=1.8×10-10。向浓度均为0.1mol⋅L-1的NaCl和NaI的混合液中逐渐加入AgNO3粉末,当溶液中I-浓度下降到mol⋅L-1时(保留一位小数),AgCl开始沉淀。组卷:49引用:1难度:0.7


