2021-2022学年内蒙古呼伦贝尔市海拉尔二中高三(上)第三次段考化学试卷
发布:2024/9/14 5:0:10
一、单项选择题(每小题3分,共42分)
-
1.化学与生产、生活、科技、环境等密切相关。下列说法正确的是( )
组卷:17引用:6难度:0.7 -
2.下列实验现象与实验操作不相匹配的是( )
实验操作 实验现象 A 将盛有Fe(OH)3胶体的烧杯置于暗处,用红色激光笔照射烧杯中的液体 在与光束垂直的方向看到一条光亮的“通路” B 向盛有少量Mg(OH)2沉淀的试管中加入适量饱和NH4Cl溶液,振荡 白色沉淀溶解 C 向盛有3.0mL无水乙醇的试管中加入一小块金属钠 有气泡产生 D 向盛有2.0mL甲苯的试管中加入3滴酸性KMnO4溶液,用力振荡 紫色不变 组卷:407引用:3难度:0.5 -
3.下列各实验装置图的叙述中,正确的是( )
组卷:4引用:6难度:0.7 -
4.对于下列描述的过程,能正确表示其反应离子方程式的是( )
组卷:22引用:4难度:0.7 -
5.已知NA表示阿伏加德罗常数,下列说法正确的是( )
组卷:8引用:4难度:0.5 -
6.阴离子Xn-含中子N个,X的质量数为A,则mgX元素的气态氢化物中含质子的物质的量是( )
组卷:719引用:50难度:0.7
二、填空题(本大题共5道小题,共58分)
-
18.丙烯是一种重要的化工原料,可以在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):C3H8(g)=C3H6(g)+H2(g)ΔH1反应Ⅱ(氧化脱氢):2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g)ΔH2(1)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是;在温度为T1时,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图a所示,计算T1时反应Ⅰ的平衡常数Kp=kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。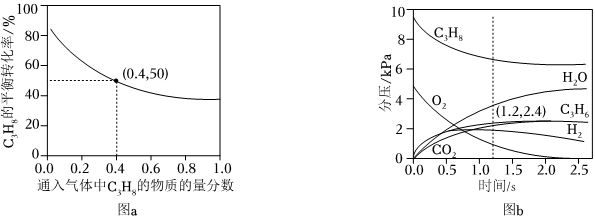
(2)在温度为T2时,通入气体分压比为p(C3H8):p(O2):p(N2)=10:5:85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2s生成C3H6的平均速率为kPa⋅s-1;在反应一段时间后,C3H8和O2的消耗速率比小于2:1的原因为。
(3)恒温刚性密闭容器中通入气体分压比为 p(C3H8):p(O2):p(N2)=2:13:85的混合气体,已知某反应条件下只发生如下反应(k,k'为速率常数):
反应Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g)k
反应Ⅲ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g)k'
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k'p(C3H6),可推测丙烯的浓度随时间的变化趋势为,其理由是。组卷:18引用:1难度:0.6 -
19.当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应。发生电离:①CO2(g)⇌CO2(aq)②CO2(aq)+H2O(l)⇌H+(aq)+(aq)25℃时,反应②的平衡常数为K2。溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol⋅L-1⋅kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为HCO-3mol⋅L-1(写出表达式,忽略的电离)。HCO-3
(2)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)(g)上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于△M2CO3(s)+H2O(g)+CO2kPa。
(3)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,Li为单质锂片,则该电池中的CO2在(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O2-4
Ⅱ.C2=CO2+O2-4CO2-2
Ⅲ.
Ⅳ.+2Li+=Li2CO3CO2-3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为。组卷:8引用:1难度:0.5


