2022-2023学年重庆市高二(上)调研化学试卷(12月份)
发布:2024/8/29 0:0:8
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1.2022年6月5日是第51个世界环境日,主题是共建清洁美丽世界。下列行为不符合该主题的是( )
组卷:0引用:1难度:0.6 -
2.发明创造为人类文明进步做出了巨大贡献。下列装置工作时,涉及的能量转化主要是化学能与电能之间的转化 的是( )




A.新型太阳能路灯 B.“长征五号”遥四运
载火箭发射C.铅酸蓄电池 D.煤气灶 组卷:74引用:5难度:0.8 -
3.化学与生产生活密切相关。下列叙述错误的是( )
组卷:20引用:5难度:0.7 -
4.铁块(一小块)与100mL0.01mol⋅L-1稀硫酸反应,为了加快此反应的速率但不改变H2的生成量。下列措施可行的是( )
组卷:3引用:1难度:0.6 -
5.下列对化学反应的预测正确的是( )
选项 化学方程式 已知条件 预测 A M(s)═X(g)+Y(s) ΔH>0 它是非自发反应 B W(s)+xG(g)═4Q(g) ΔH<0,自发反应 x可能等于1、2、3 C 4X(g)+5Y(g)═4W(g)+6G(g) 能自发反应 ΔH一定小于0 D 4M(s)+N(g)+2W(l)═4Q(s) 常温下,自发进行 ΔH>0 组卷:219引用:6难度:0.5 -
6.可逆反应2SO2(g)+O2(g)⇌2SO3(g),某温度下的平衡常数为K(K≠1),反应热为ΔH。保持温度不变,将方程式的书写作如下改变,则ΔH和K的相应变化为( )
组卷:4引用:1难度:0.7
二、非选择题:本题共4小题,共58分。
-
17.电化学的发展是化学对人类的一项重大贡献。探究原电池和电解池原理,对生产生活具有重要的意义。
(1)利用甲醇燃料电池(甲池)作电源同时电解乙池和丙池。
①放电时,K+向(填“A极”或“B极”)移动;KOH溶液过量时,甲池中负极的电极反应式为。
②当乙池中C极质量减轻5.4g时,甲池中B极理论上消耗O2的体积为mL(标准状况)。
③一段时间后,断开电键K,欲使丙池恢复到反应前的浓度,可加入的试剂是(填化学式)。
(2)氯碱工业是高耗能产业,将电解池与燃料电池相组合的新工艺可以节能30%以上,相关物料的传输与转化关系如图所示,其中的电极未标出所用的离子膜都只允许阳离子通过。
①图中Y是(填化学式);X与NaOH稀溶液反应的离子方程式为。
②比较图示中氢氧化钠的质量分数a%与b%的大小:。
③若用装置B作为装置A的辅助电源,则每消耗标准状况下11.2L氧气时,装置B可向装置A提供的电量约为(一个e-的电量为1.60×10-19C,计算结果精确到0.01)。组卷:8引用:1难度:0.5 -
18.消除氮氧化物的污染是当前科学研究的热点,根据所学知识回答下列问题:
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1=+akJ•mol-1;②C(s)的燃烧热为ΔH2=-bkJ•mol-1。则反应C(s)+2NO(g)⇌N2(g)+CO2(g)的ΔH=kJ•mol-1(用含a、b的代数式表示)。
(2)已知NO2和N2O4可以相互转化,反应2NO2(g)⇌N2O4(g) ΔH=-57.2kJ•mol-1。在温度一定时,平衡体系中NO2的体积分数ω(NO2)随压强的变化情况如图所示。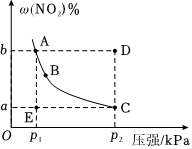
①A、C两点的正反应速率的关系为v(A)(填“>”、“<”或“=”)v(C)。
②A、B、C、D、E各状态,v(正)>v(逆)的是状态。
③E→A所需时间为x,D→C所需时间为y,则x(填“>”、<“或“=”)y。
(3)在一定条件下,NH3可还原氮氧化物,消除氮氧化物污染。工业上,常用N2和H2在催化剂作用下合成NH3。在催化剂作用下,n(N2):n(H2)=1:3时,发生反应,平衡混合气中NH3的物质的量分数随温度和压强变化的关系如图所示。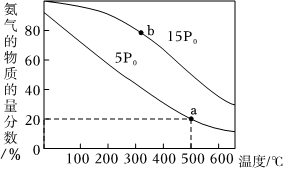
①该反应的平衡常数K(a)(填“<”、“=”或“>”)K(b)。
②500℃、压强为5P0时,H2的转化率为%(保留三位有效数字),Kp=。[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]组卷:33引用:5难度:0.7


