鲁科版(2019)选择性必修1《第2章 化学反应的方向、限度与速率》2023年单元测试卷(10)
发布:2024/8/17 2:0:1
一、选择题
-
1.在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)⇌C(g)+D(g),当下列物理量不再变化时,能够表明该反应已达平衡状态的是( )
组卷:16引用:3难度:0.7 -
2.对处于平衡状态的反应:2A(g)+B(g)⇌2C(g)△H<0,下列叙述正确的是( )
组卷:28引用:5难度:0.9 -
3.实验室用锌粒与2mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
组卷:17引用:9难度:0.9 -
4.向密闭容器中充入1molH2(g)和1molI2(g),压强为p,并在一定温度下发生反应:H2(g)+I2(g)、⇌2HI(g)ΔH<0,一段时间后反应达到平衡。下列说法不正确的是( )
组卷:6引用:2难度:0.5 -
5.下列说法不正确的是( )
组卷:62引用:5难度:0.5 -
6.在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)⇌CO2(g)+N2(g),平衡时c(NO)随温度T的变化如下图所示,则下列说法正确的是( )
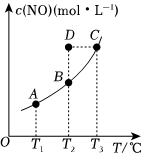 组卷:20引用:3难度:0.5
组卷:20引用:3难度:0.5 -
7.在一定条件下,对于密闭容器中的反应N2(g)+3H2(g)⇌2NH3(g),下列说法正确的是( )
组卷:18引用:2难度:0.5 -
8.恒容容器中,放热反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在温度T1时达到平衡,平衡时CO与H2O的浓度均为1.0mol•L-1,其平衡常数为K1。升高反应体系的温度至T2时,反应物的平衡浓度分别为amol•L-1和bmol•L-1,平衡常数为K2,则( )
组卷:7引用:2难度:0.4
四、解答题
-
 23.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
23.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)利用反应:6NO2+8NH37N2+12H2O 可以处理硝酸生产中的NO2,消除尾气污染.上述反应中,每当转移1.2mol电子时,消耗的NO2在标准状况下是催化剂加热L.
(2)(已知:2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g) 的△H=kJ•mol-1.
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是.
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molNO2的同时生成1mol SO3
当测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=.
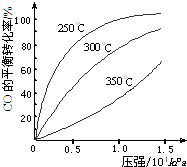
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此条件的理由是.组卷:11引用:2难度:0.5 -
 24.氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。
24.氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。
(1)在373 K时,向体积为2 L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)⇌N2O4(g)△H=-57.0 kJ•mol-1.测得NO2的物质的量分数[φ(NO2)]与反应时间(t)的关系如表:
①0~20 min内,v(N2O4)=t/min 0 20 40 60 80 φ(NO2) 1.0 0.75 0.52 0.40 0.40 mol•L-1•min-1。
②上述反应中,v正(NO2)=k1•c2(NO2),v逆(N2O4)=k2•c(N2O4),其中k1、k2为速率常数,则373 K时,k1、k2的数学关系式为。
改变温度至T1时k1=k2,则T1373 K(填“>”“<”或“=”)。
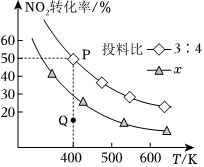
(2)NH3催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:6NO2(g)+8NH3(g)⇌7N2(g)+12H2O(l)△H,向容积为2 L的恒容密闭容器中,充入NO2和NH3的混合气体0.14 mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
①△H0(填“>”“<”或“=”)。
②x3:4(填“>”“<”或“=”)。
③400 K时,反应的平衡常数为(填计算式即可)。
④投料比为3:4时,Q点v逆(NH3)(填“>”“<”或“=”)P点v逆(NH3)。组卷:58引用:4难度:0.5


