人教版(2019)选择性必修1《3.4.2 沉淀溶解平衡的应用》2023年同步练习卷(5)
发布:2024/8/16 13:0:1
一、选择题
-
1.实验:
①0.1mol•L-1AgNO3溶液和0.1mol•L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1mol•L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1mol•L-1KI溶液,沉淀变为黄色.
下列分析不正确的是( )组卷:1376引用:52难度:0.9 -
2.如表所示是三种物质的溶解度(20℃),下列说法正确的是( )
物质 MgCl2 Mg(OH)2 MgCO3 溶解度(g/100g H2O) 54.8 9×10-4 0.01 组卷:9引用:6难度:0.5
三、解答题
-
10.请按要求回答下列问题:
Ⅰ.已知H2A在水中的电离如下:H2A═H++HA-,HA-⇌H++A2-。
(1)常温下NaHA溶液的pH(填字母,下同),原因是。
A.大于7
B.小于7
C.等于7
D.无法确定
(2)某温度下,若向0.1mol•L-1的NaHA溶液中逐滴滴加0.1mol•L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是。
A.c(H+)•c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol•L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有。
A.升高温度
B.降低温度
C.加入NH4Cl晶体
D.加入Na2A固体
Ⅱ.(4)已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。向0.0180mol•L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为。(忽略溶液体积变化)
(5)25℃时,pH=5的CH3COOH溶液中,c(CH3COO-)=。(写出计算式)组卷:30引用:2难度:0.5 -
11.水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.水中溶解氧的测定步骤如下:
(1)向一定量水样中加入适量MnSO4和碱性KI 溶液,生成MnO(OH)2沉淀,密封静置;
(2)加入适量稀H2SO4,搅拌,等MnO(OH)2与I-完全反应生成Mn2+和I2后;
(3)用Na2S2O3标准溶液滴定至终点.测定过程中物质的转化关系如下:
O2MnO(OH)2Mn2+I2I-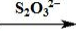 S4O2-6
S4O2-6
已知:MnO(OH)2+2I-+4H+═Mn2++I2+3H2O
2S2O32-+I2═S4O6 2-+2I-
①加入稀硫酸后搅拌的作用是;Na2S2O3标准溶液应装在滴定管中(填酸式或碱式).
②滴定过程中以为指示剂;达到滴定终点的标志为.
③写出O2将Mn2+氧化成MnO(OH)2的离子方程式;
④若加入的稀H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差.写出产生误差的一个原因(用离子方程式表示).
⑤下列操作使测得水样中溶氧量(DO)比实际值偏高的是
A.第(1)步操作静置时没有密封 B.装Na2S2O3标准溶液的滴定管没有润洗
C.滴定前锥形瓶洗净后没有干燥 D.滴定前读数正确,滴定后俯视读数
⑥取加过一定量CaO2•8H2O的池塘水样100.00mL,按上述方法测定水中溶解氧量,消耗0.01000mol•L-1 Na2S2O3标准溶液13.50mL.计算该水样中的溶解氧为mg•L-1.组卷:20引用:3难度:0.3


