2021-2022学年四川省峨眉二中高二(下)月考化学试卷(5月份)
发布:2024/9/19 0:0:8
一、选择题(本题包括20小题,每小题2.5分,共50分;每小题只有一个选项符合题意)
-
1.下列叙述正确的是( )
组卷:24引用:3难度:0.9 -
2.下列依据热化学方程式得出的结论正确的是( )
组卷:7引用:6难度:0.5 -
3.已知:2Zn(s)+O2(g)=2ZnO(s);ΔH=-701.0kJ•mol-1
2Hg(l)+O2(g)=2HgO(s);ΔH=-181.6kJ•mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )组卷:838引用:34难度:0.7 -
4.已知:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1.某温度下的平衡常数为400.此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是( )
物质 CH3OH CH3OCH3 H2O c/(mol•L-1) 0.08 1.6 1.6 组卷:86引用:9难度:0.9 -
5.下列有关叙述正确的是( )
组卷:14引用:5难度:0.9 -
6.醋酸溶液中存在电离平衡CH3COOH⇌H++CH3COO-,下列叙述不正确的是( )
组卷:7引用:3难度:0.5 -
7.常温下,浓度均为0.1mol•L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )
组卷:250引用:11难度:0.7 -
8.下列有关电解质溶液的说法正确的是( )
组卷:3210引用:46难度:0.7
二、非选择题(本题包括4小题,共50分)
-
23.过氧化钙是一种温和的氧化剂,常温下为白色固体,易溶于酸,难溶于水、乙醇等溶剂。
(1)某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙,按气流方向连接顺序为(填仪器接口的字母编号,装置可重复使用);实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后,先熄灭酒精灯,待反应管冷却至室温后,停止通入气体;④拆除装置,取出产物。实验步骤③的操作目的是。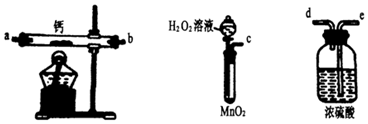
(2)利用反应Ca2++H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4+,在碱性环境下制取CaO2•8H2O的装置如下: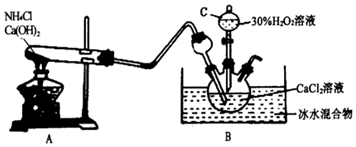
①仪器C的名称;反应结束后,经(填操作名称)、洗涤、低温烘干可获得CaO2•8H2O。
②装置A中发生反应的化学方程式为;装置B中用冰水浴控制温度,其可能原因是。
③测定产品中CaO2•8H2O的含量的实验步骤如下:
步骤一:准确称取a g产品放入锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴(作指示剂)。
步骤三:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体积为VmL.则CaO2•8H2O的质量分数为(用含字母的式子表示)。[已知:I2+2S2O32-=2I-+S4O62-]组卷:10引用:3难度:0.5 -
24.某科研课题小组研究利用含H+、Na+、Zn2+、Mn2+、Fe2+、Fe3+、SO
的工业废电解质溶液,制备高纯的ZnO、MnO2、Fe2O3,设计实验流程如图:2-4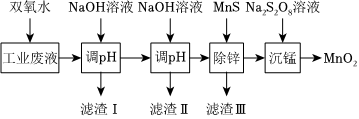
回答下列问题:
(1)加入双氧水的目的是,写出相应的离子方程式。
(2)第一次调pH使Fe3+完全沉淀,写出反应的离子方程式。
(3)第二次调pH前,科研小组成员分析此时的溶液,得到常温下相关数据如表(表中金属离子沉淀完全时,其浓度为1×10-5 mol•L-1)。
为防止Mn2+同时沉淀造成产品不纯,最终选择将溶液的pH控制为7,则此时溶液中Zn2+的沉淀率为浓度/
(mol•L-1)氢氧化物的
Ksp开始沉淀的
pH沉淀完全的
pHZn2+ 0.12 1.2×10-17 6.0 8.1 Mn2+ 0.10 4.0×10-14 7.8 9.8 ,利用滤渣Ⅱ制备高纯的ZnO时,必然含有极其微量的(以化学式表示)。
(4)已知常温下,Ksp(MnS)=3.0×10-14,Ksp(ZnS)=1.5×10-24,在除锌时发生沉淀转化反应为:MnS(s)+Zn2+(aq)⇌ZnS(s)+Mn2+(aq),其平衡常数K=。
(5)沉锰反应在酸性条件下完成,写出该反应的离子方程式。组卷:2引用:1难度:0.5


