某科研课题小组研究利用含H+、Na+、Zn2+、Mn2+、Fe2+、Fe3+、SO2-4的工业废电解质溶液,制备高纯的ZnO、MnO2、Fe2O3,设计实验流程如图:
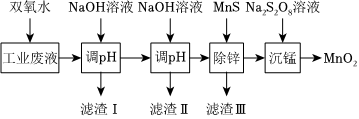
回答下列问题:
(1)加入双氧水的目的是 将Fe2+氧化为Fe3+将Fe2+氧化为Fe3+,写出相应的离子方程式 2Fe2++H2O2+2H+═2Fe3++2H2O2Fe2++H2O2+2H+═2Fe3++2H2O。
(2)第一次调pH使Fe3+完全沉淀,写出反应的离子方程式 Fe3++3OH-=Fe(OH)3↓Fe3++3OH-=Fe(OH)3↓。
(3)第二次调pH前,科研小组成员分析此时的溶液,得到常温下相关数据如表(表中金属离子沉淀完全时,其浓度为1×10-5 mol•L-1)。
2
-
4
| 浓度/ (mol•L-1) |
氢氧化物的 Ksp |
开始沉淀的 pH |
沉淀完全的 pH |
|
| Zn2+ | 0.12 | 1.2×10-17 | 6.0 | 8.1 |
| Mn2+ | 0.10 | 4.0×10-14 | 7.8 | 9.8 |
99%
99%
,利用滤渣Ⅱ制备高纯的ZnO时,必然含有极其微量的 Fe2O3
Fe2O3
(以化学式表示)。(4)已知常温下,Ksp(MnS)=3.0×10-14,Ksp(ZnS)=1.5×10-24,在除锌时发生沉淀转化反应为:MnS(s)+Zn2+(aq)⇌ZnS(s)+Mn2+(aq),其平衡常数K=
2×1010
2×1010
。(5)沉锰反应在酸性条件下完成,写出该反应的离子方程式
Mn2++S2+2H2O=MnO2↓+2+4H+
O
2
-
8
SO
2
-
4
Mn2++S2+2H2O=MnO2↓+2+4H+
。O
2
-
8
SO
2
-
4
【答案】将Fe2+氧化为Fe3+;2Fe2++H2O2+2H+═2Fe3++2H2O;Fe3++3OH-=Fe(OH)3↓;99%;Fe2O3;2×1010;Mn2++S2+2H2O=MnO2↓+2+4H+
O
2
-
8
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/19 0:0:8组卷:2引用:1难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质)。用该烧渣制取药用辅料-红氧化铁的工艺流程如图:
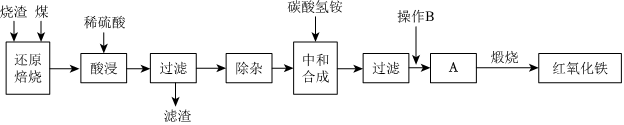
(1)在“还原焙烧”中产生的有毒气体可能有。
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示)。
(3)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是。
(4)煅烧A的反应方程式是。
(5)ag烧渣经过上述工艺可得红氧化铁bg。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示)。发布:2025/1/19 8:0:1组卷:30引用:1难度:0.5 -
2.我国青藏高原的盐湖中蕴藏着丰富的锂资源,已探明的储量约三千万吨,碳酸锂制备高纯金属锂的一种工艺流程如图。下列有关说法错误的是( )
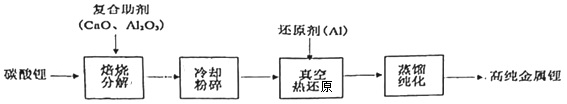 发布:2025/1/6 7:30:5组卷:28引用:2难度:0.9
发布:2025/1/6 7:30:5组卷:28引用:2难度:0.9 -
3.查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
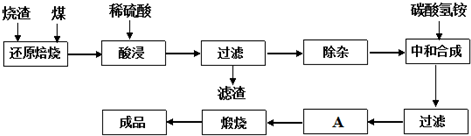
(1)焙烧时产生的主要有害气体是.
(2)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验Fe3+已经除尽的试剂是(除KSCN外).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.1


