2022-2023学年上海市建平中学等级班高二(下)期末化学试卷
发布:2024/8/16 3:0:1
1
-
1.汽车是现代社会重要的交通工具之一,化学物质在汽车的动力、安全等方面有着极为重要的作用。
Ⅰ.氨气是制备NaN3(叠氮化钠)的原料之一,汽车安全气囊中的填充物有NaN3、SiO2、KNO3等物质,NaN3遇撞击时能生成金属钠和N2。
(1)上述列举的三种汽车安全气囊填充物中属于共价化合物的是(填化学式),所涉及的5种元素中,非金属元素的原子半径由大到小的顺序为。
(2)请列举一个事实说明N元素与O元素的非金属性强弱。
(3)下列有关化学用语表示正确的是。
A.Ne和N3-的结构示意图均为
B.二氧化硅的分子式:SiO2
C.氨气的空间填充模型:
D.NH4Br的电子式:
(4)的空间构型为NO-3。
A.平面三角形
B.三角锥形
C.四面体形
D.直线形
Ⅱ.NaN3是由一种单原子离子和多原子离子以1:1的比例构成的化合物。
(5)叠氮化钠固体中所含化学键的类型为,叠氮化钠的晶体类型为。
(6)写出叠氮化钠分解的化学方程式。
(7)工业通过反应一:2NH3+2Na=2NaNH2+H2↑
反应二:2NaNH2+N2O=NaN3+NaOH+NH3
制备NaN3,下列有关说法中正确的是(双选)。
A.反应一每生成5.6L氢气(已换算至标准状况下的体积),转移电子数目为NA
B.反应一中NaNH2为强电解质,NH3为弱电解质
C.反应二中生成的氨气可以循环利用
D.与NaN3同为碱金属叠氮化物的LiN3受撞击分解产生Li3N和氮气,反应过程中发生了离子键和共价键的破坏与形成
Ⅲ.SiO2、KNO3能与分解出的金属钠发生反应生成Na2SiO3,化学方程式为:Na+KNO3+SiO2→Na2SiO3+K2SiO3+N2↑(未配平)。
(8)配平上述化学方程式,并用单线桥法标出电子转移的方向和数目:Na+KNO3+SiO2=Na2SiO3+K2SiO3+N2↑。
(9)在该反应中KNO3体现(填“氧化性”或“还原性”),Na2SiO3为(填“氧化产物”或“还原产物”)。
(10)当反应转移5mol电子时,生成标准状况下的氮气L。组卷:53引用:1难度:0.6
1
-
3.碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
(1)实验Ⅰ中红褐色沉淀的化学式为实验 试剂 现象 滴管(一滴管) 试管(2mL) 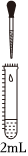
0.8mol/LFeSO4溶液
(pH=4.5)1mol/LNa2CO3溶液
(pH=11.9)实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 0.8mol/LFeSO4溶液
(pH=4.5)1mol/LNaHCO3溶液
(pH=8.6)实验Ⅱ:产生白色沉淀及少量无色气 泡,2min 后出现明显的灰绿色 0.8mol/L(NH4)2Fe(SO4)2溶液
(pH=4.0)1mol/LNaHCO3溶液
(pH=8.6)实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 。
(2)实验Ⅱ中产生白色沉淀FeCO3及少量无色气泡的离子方程式为。
(3)小组同学讨论认为,定性实验现象并不能直接证明实验Ⅲ中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。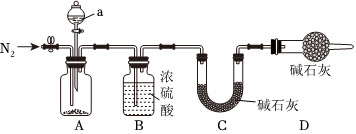
将实验所得的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中,经一系列操作后,称量装置C的增重来测定沉淀中FeCO3的纯度。
①仪器a的名称为,所盛试剂应选择下列试剂中的(填字母),请写出A中FeCO3发生反应的离子方程式。
A.稀盐酸
B.稀硝酸
C.稀硫酸
②B中浓硫酸的作用为,若无该装置,则测定结果会(填“偏大”“偏小”或“无影响”);D中碱石灰的作用为。
③在A中充分反应后打开左侧止水夹通入一段时间的N2,其目的是。
(4)实验反思:经测定,实验Ⅲ中的FeCO3纯度高于实验Ⅰ和实验Ⅱ。通过以上实验分析,制备FeCO3实验成功的关键因素是。组卷:24引用:1难度:0.3 -
4.奥昔布宁是具有解痉和抗胆碱作用的药物。其合成路线如图:
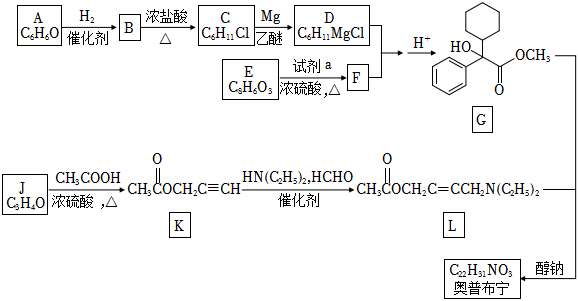
已知:
①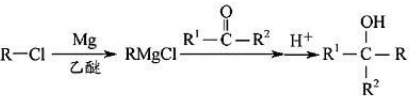
②R3COOR4+R5COOR6R3COOR6+R5COOR4醇钠△
(1)芳香族化合物A中含氧官能团的名称是,G中含氧官能团的名称是。
(2)A→B的反应类型是,B→C的反应类型是。
(3)F的结构简式是。
(4)J→K的化学方程式是。
(5)已知:G、L和奥昔布宁的沸点均高于200℃。G和L发生反应合成奥昔布宁时,通过在70℃左右蒸出(填物质名称)来促进反应。
(6)奥昔布宁的结构简式是。
(7)E的同分异构体有多种,符合下列条件的共有种,请写出其中一种的结构简式。
①含有苯环 ②能发生银镜反应
②核磁共振氢谱中有4组不同的峰
(8)结合题中信息,以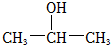 为有机原料,设计合成
为有机原料,设计合成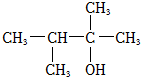 的路线 。(无机试剂与溶剂任选,合成路线可表示为:AB••••••反应试剂反应条件目标产物)反应试剂反应条件组卷:55引用:1难度:0.5
的路线 。(无机试剂与溶剂任选,合成路线可表示为:AB••••••反应试剂反应条件目标产物)反应试剂反应条件组卷:55引用:1难度:0.5


