2022-2023学年上海市向明中学高一(下)期末化学试卷
发布:2024/7/23 8:0:8
解答题
-
1.元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。
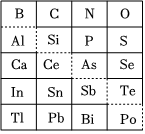
Ⅰ.如图是元素周期表的一部分,回答下列问题。
(1)硒在元素周期表中的位置是:第周期第族;
(2)二硫化硒(SeS2)具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。SeS2中硫元素的化合价为负价,请从原子结构角度解释原因:。
(3)可在图中分界线(虚线)附近寻找(填序号)。
A.优良的催化剂
B.半导体材料
C.合金材料
Ⅱ.随着原子序数的递增,七种短周期元素的原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。请回答下列问题: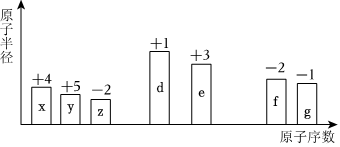
(4)x的氢化物中含有的化学键类型为(填“离子键”或“共价键”)。
(5)z、d、e的简单离子半径由大到小的顺序为(用离子符号表示)。
(6)d的单质在空气中充分燃烧,所得产物的化学式为。
(7)e的单质化学性质活泼,但在空气中能稳定存在,也能用于制作炊具的原因是。(可用化学方程式表示,也可用文字说明)
(8)能说明g的非金属性比f的强的实验事实是(列举一条)。组卷:62引用:1难度:0.7
解答题
-
4.Ⅰ.铁及其化合物在生产生活中有十分广泛的应用。
(1)在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。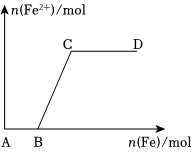
请将正确答案的序号填在相应的横线上。
①Fe3+;②Fe2+;③Fe、Fe2+;④Fe2+、Fe3+
①AB段铁元素以形式存在。
②BC段铁元素以形式存在
③CD段铁元素以形式存在。
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:。
Ⅱ.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。已知某补铁剂不溶于水但能溶于人体中的胃液(含盐酸)。某同学为了检测该补铁剂中Fe2+的存在,设计并进行了如下实验:
(3)试剂2的化学式是。加入试剂2后溶液变为浅红色,此现象说明溶液①中含有(填微粒符号)。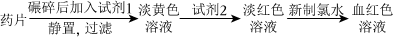
(4)加入新制氯水,溶液中发生反应的离子方程式是。
(5)不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式。
(6)某同学通过如图实验测定该补铁剂中铁元素的含量。试计算:每片该补铁剂含铁元素的质量为g(用含a、m的代数式表示)。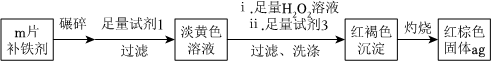 组卷:163引用:1难度:0.5
组卷:163引用:1难度:0.5 -
5.钠和铁是重要的金属,其单质及化合物在生产生活中有着重要的应用。
(1)把等物质的量的碳酸氢钠和过氧化钠放在密闭容器中加热,完全反应后排出气体。剩余固体的成分包括,其物质的量之比为。若排出的气体的质量为1.6克,则原混合固体的质量为克。
工业上用黄铁矿(FeS2)为原料制备硫酸的主要流程如图: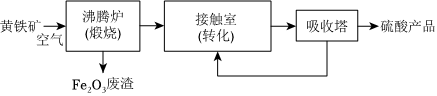
(2)若废渣含铁量高,可直接作为炼铁的原料。冶炼金属铁的方法有。
A.热还原法
B.电解法
C.热分解法
D.铝热反应
(3)有关工业制硫酸的下列说法中,正确的是。
A.二氧化硫的催化氧化在接触室中发生
B.从吸收塔循环回接触室的物质只有SO2
C.接触室中装有热交换器
D.从沸腾炉出来的原料气可以直接进入接触室进行转化
(4)在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行,吸收塔里还装入了大量瓷环。下列有关说法错误的是。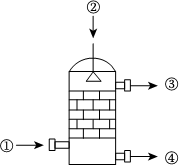
A.从①处通入的气体中含大量SO3,整个吸收操作采取逆流的形式
B.从②处喷下水,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
(5)硫酸工业生产中,根据化学平衡原理来确定的条件或措施有;有利于提高相关反应速率的条件或措施有。
A.含铁矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.排出的酸性废水用石灰乳中和处理
(6)我国二氧化硫排放标准限值为100mg/m3。硫酸工业废气(假设含硫化合物均为SO2)可采用雾化的氨水与废气中的SO2直接接触吸收SO2,若烟气SO2含量为amg/m3(a>100),试计算每立方米烟气至少需要浓度为bmol/L氨水L(用含a、b的代数式表示)。组卷:88引用:1难度:0.7


