人教版(2019)选择性必修1《3.1 电离平衡》2023年同步练习卷(1)(2)
发布:2024/8/16 16:0:2
一、选择题
-
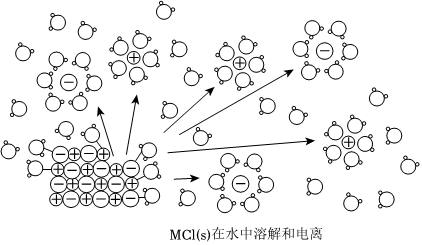 1.某离子化合物MCl(s)在水中溶解并发生电离,该过程的微观示意图如图。已知NA为阿伏加德罗常数的值,下列相关说法正确的是( )组卷:14引用:3难度:0.6
1.某离子化合物MCl(s)在水中溶解并发生电离,该过程的微观示意图如图。已知NA为阿伏加德罗常数的值,下列相关说法正确的是( )组卷:14引用:3难度:0.6 -
2.下列说法中,正确的是( )
组卷:44引用:7难度:0.9 -
3.常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+,温度不变时,对于该电离平衡下列叙述正确的是( )
组卷:19引用:3难度:0.5 -
4.下列物质在水溶液中的电离方程式书写正确的是( )
组卷:32引用:2难度:0.6
二、解答题
-
13.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:化学式 CH3COOH H2CO3 HClO 电离平衡常数 1.7×10-5 K1=4.3×10-7
K2=5.6×10-113.0×10-8
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为。
(2)写出H2CO3的电离方程式:。
(3)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填字母序号)。
A.c(H+)
B.c(H+)c(CH3COOH)
C.c(CH3COO-)•c(H+)c(CH3COOH)
D.c(CH3COO-)
(4)取0.10molCH3COOH (冰醋酸)做导电性实验,测得其导电率随加入的水量变化如图所示,比较a、b点的相关性质(填“>”“<”或“=”):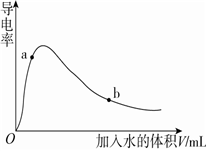
n(H+):ab;c(CH3COO-):ab;完全中和时消耗NaOH的物质的量:ab。组卷:22引用:2难度:0.5 -
14.电解质水溶液中存在电离平衡、水解平衡、沉淀溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol•L-1NaCN溶液和0.1mol•L-1NaHCO3溶液中,c(CN-)弱酸 CH3COOH HCN H2CO3 电离常数(25℃) Ka=1.8×10-5 Ka=4.3×10-10 Ka1=5.0×10-7
Ka2=5.6×10-11c(HCO3-)。(填“>”、“<”或“=”)
②常温下,下列pH相同的三种溶液:其物质的量浓度由大到小的顺序是。(填编号)
A.CH3COONa
B.NaCN
C.Na2CO3
③将少量CO2通入NaCN溶液,反应的离子方程式是。
(2)室温下,SO2通入NaOH溶液中,在所得溶液中c(HSO3-):c(SO32-)=10:1,溶液pH=。(室温下,H2SO3的Ka1=5.4×10-2;Ka2=1.0×10-7)
(3)已知25℃氯水溶液中Cl2(aq)、HClO和ClO-分别所占分数(α)随pH变化的关系如图所示。由图可知该温度下HClO的电离常数值为。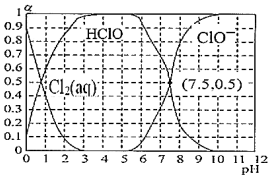
(4)已知:
常温下NH3•H2O⇌NH4++OH- Kb=1.8×10-5
H2Y⇌H++HY- Ka1=5.4×10-2
HY-⇌H++Y2- Ka2=5.4×10-5
则(NH4)2Y溶液的pH7。(填“>”、“<”或“=”)
(5)已知25℃时Ksp[Fe(OH)3]=8.0×10-38,此温度下若在实验室中配制100mL 0.01mol•L-1FeCl3溶液,在配制过程中容易出现浑浊现象,其原因是(用离子方程式表示其原因),所以在配制过程中要加入适量盐酸。组卷:20引用:2难度:0.6


