电解质水溶液中存在电离平衡、水解平衡、沉淀溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
<
<
c(HCO3-)。(填“>”、“<”或“=”)②常温下,下列pH相同的三种溶液:其物质的量浓度由大到小的顺序是
A>B>C
A>B>C
。(填编号)A.CH3COONa
B.NaCN
C.Na2CO3
③将少量CO2通入NaCN溶液,反应的离子方程式是
CN-+CO2+H2O=HCN+HCO3-
CN-+CO2+H2O=HCN+HCO3-
。(2)室温下,SO2通入NaOH溶液中,在所得溶液中c(HSO3-):c(SO32-)=10:1,溶液pH=
6
6
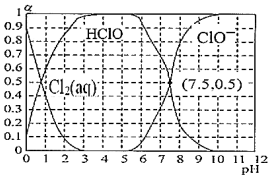
。(室温下,H2SO3的Ka1=5.4×10-2;Ka2=1.0×10-7)(3)已知25℃氯水溶液中Cl2(aq)、HClO和ClO-分别所占分数(α)随pH变化的关系如图所示。由图可知该温度下HClO的电离常数值为
10-7.5
10-7.5
。
(4)已知:
常温下NH3•H2O⇌NH4++OH- Kb=1.8×10-5
H2Y⇌H++HY- Ka1=5.4×10-2
HY-⇌H++Y2- Ka2=5.4×10-5
则(NH4)2Y溶液的pH
<
<
7。(填“>”、“<”或“=”)(5)已知25℃时Ksp[Fe(OH)3]=8.0×10-38,此温度下若在实验室中配制100mL 0.01mol•L-1FeCl3溶液,在配制过程中容易出现浑浊现象,其原因是
Fe3++3H2O⇌Fe(OH)3+3H+
Fe3++3H2O⇌Fe(OH)3+3H+
(用离子方程式表示其原因),所以在配制过程中要加入适量盐酸。【考点】弱电解质的电离平衡.
【答案】<;A>B>C;CN-+CO2+H2O=HCN+HCO3-;6;10-7.5;<;Fe3++3H2O⇌Fe(OH)3+3H+
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 16:0:2组卷:20引用:2难度:0.6


